重磅 | 3篇Nature背靠背发表,科学家发现新型的致癌机制
在所有真核细胞中,基因表达分三步进行,分别由RNA聚合酶(RNA polymerase)、剪接体(Spliceosome)、和核糖体(Ribosome)执行。首先,储存在遗传物质DNA序列中的遗传信息必须通过RNA聚合酶的作用转变成前体信使RNA (precursor messenger RNA, 简称pre-mRNA),这一步简称转录(transcription);其次,前体信使RNA由多个内含子和外显子间隔形成,必须通过剪接体的作用去除内含子、连接外显子之后才能转变为成熟的信使RNA,这一步简称剪接(splicing);第三,成熟的信使RNA必须通过核糖体的作用转变成蛋白质之后才能行使生命活动的各种功能。描述这一过程的规律被称为生物学的中心法则,其在生命科学领域具有核心重要性。但是,现在Nature 背靠背发表3篇文章,揭示剪接过程的异常,会导致肿瘤的发生。
癌症是由称为驱动因子的基因组改变引起的。尽管已知有数百种编码基因的驱动程序,虽然进行了深入的已经,但迄今为止仅发现了少数非编码驱动程序。相比之下,由于表征非编码癌症驱动程序的综合挑战和snRNA基因的重复性,对剪接体非编码成分,一系列小核RNA(snRNA)的癌症相关改变的研究很少。2019年10月9日,Lincoln D. Stein团队在Nature 在线发表题为"The U1 spliceosomal RNA is recurrently mutated in multiple cancers"的研究论文,该研究报告了在几种肿瘤类型中,U1 snRNA的第三个碱基处高度复发的A> C体细胞突变。U1的主要功能是通过碱基配对识别5'剪接位点(5'SS)。此突变将U1和5'SS之间的优先A-U碱基配对更改为C-G碱基配对,从而创建新的剪接点并改变了多个基因的剪接模式,包括已知的癌症驱动程序。在临床上,A> C突变与肝细胞癌(HCC)的酒精滥用和慢性淋巴细胞性白血病(CLL)的侵袭性IGHV亚型相关。该研究证明了剪接体RNA中最早的非编码驱动程序之一,揭示了癌症中异常剪接的新机制,这可能代表了新的治疗靶标。
癌症中的复发性体细胞单核苷酸变异(SNV)很大程度上局限于蛋白质编码基因,在大多数儿科癌症中很少见。2019年10月9日,Michael D. Taylor团队在Nature 在线发表题为"Recurrent non-coding U1-snRNA mutations drive cryptic splicing in Shh medulloblastoma"的研究论文,该研究报道了约50%的Sonic hedgehog髓母细胞瘤(Shh-MB)中U1剪接小核RNA(snRNA)的高度复发性热点突变,该突变在其他髓母细胞瘤亚组中均不存在。U1-snRNA突变发生在5'剪接位点结合区域,并且snRNA突变型肿瘤已显著破坏RNA剪接,并带有过量的5'剪接事件。突变的U1-snRNA介导的可变剪接使肿瘤抑制基因(PTCH1)失活,并激活癌基因(GLI2,CCND2),这是治疗的新靶点,并构成了在癌症非蛋白质编码基因的高度复发性和组织特异性突变。
SF3B1是癌症中最常见的突变的RNA剪接因子,但对SF3B1突变促进恶性肿瘤的机制了解甚少。2019年10月9日,Robert K. Bradley及Omar Abdel-Wahab共同通讯在Nature 在线发表题为"Spliceosomal disruption of the non-canonical BAF complex in cancer"的研究论文,该研究发现突变体SF3B1识别BRD9中的内含子分支点,从而诱导包含内源性逆转录病毒元件的毒性外显子的掺入以及随后BRD9 mRNA的降解。BRD9的消耗会导致CTCF相关基因座上非典型BAF的丢失,并促进黑色素瘤的发生。 该研究结果暗示了非典型BAF在携带SF3B1突变的多种癌症类型中的破坏,并提出了一种基于机制的治疗方法来治疗这些恶性肿瘤。
剪切过程背景介绍
在1977年,Phillip Sharp和Richard Roberts俩个研究组独立发现了剪切这一过程,紧接着,1979年, Steitz研究组发现五种称为U1,U2,U4,U5和U6 snRNA的富含尿苷的小核RNA(snRNA)和7种12-35kDa的蛋白质(snRNPs)。之后, Steitz等研究组发现U1 snRNA的5'末端序列被识别为与5'剪接位点(5'SS)互补,并且snRNP被部分纯化。纯化的U1snRNP在体外特异性结合到5'SS上,并且U1snRNP的消耗抑制了体外剪接。随后,证实了多个snRNPs参与前mRNA剪接。
剪接测定的发展使得剪切反应的描绘成为可能。发现ATP和镁(Mg2 +)对于腺病毒前体mRNA的体外剪接是必不可少的。通过分支点序列(BPS)中的腺苷核苷酸和5'SS的5'末端的鸟嘌呤核苷酸之间的连接形成内含子套索结构,得到了生物化学证实。
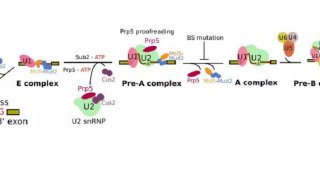
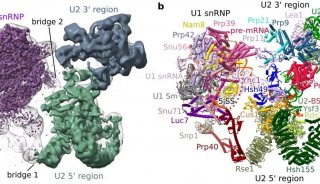
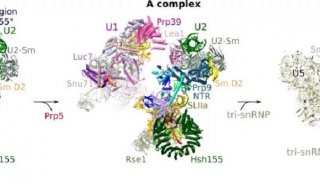
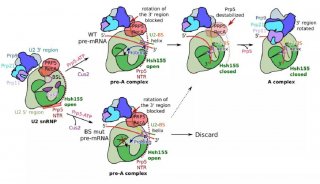
前体mRNA剪接是由剪接体催化的,剪接体是一种高度动态和复杂的分子机器,它含有前体mRNA,U1,U2,U4 / U6和U5 snRNPs以及许多非snRNP蛋白。U1和U2 snRNP分别与内含子的5'剪接位点(ss)和分支位点(BS)相互作用,同时为U4 / U6.U5 tri-snRNP的稳定整合铺平了道路,产生了剪接体B复合物。然而,尽管tri-snRNP引入了必需的催化组分,但是剪接体B复合物仍然需要转化成催化活性复合物,这一过程需要广泛的结构重排。通过解开U4 snRNA的U4 / U6双链体(通过RNA解旋酶Brr2)启动活化, U6随后与U2(U2 / U6螺旋Ia和螺旋Ib)以及内部茎环(U6 ISL)自由地形成短双链体。最终在剪接体激活期间建立的催化RNA-RNA网络与II组自我剪接内含子的催化核心非常相似。

剪切过程
随后通过RNA解旋酶PRP2将所得的活化的但是预催化的B(Bact)复合物转化为催化剪接体(命名为B *)。在人类中,B-to-B *转换也需要AQR RNA解旋酶的ATP酶活性,这在酵母酿酒酵母的剪接体中是不存在的。这表明人类剪接体中催化活化所需的构象重排比酵母中的那些更复杂。B *复合物催化剪切的第一步,产生切割的5'外显子和内含子3'外显子套索中间体,产生剪接体C复合物。额外的RNP重排将C复合物转化为C *复合物,然后催化第二步剪接,并且5'和3'外显子的连接形成mRNA并释放内含子作为套索。
U1剪接体RNA在多种癌症中反复突变
癌症是由称为驱动因子的基因组改变引起的。尽管已知有数百种编码基因的驱动程序,虽然进行了深入的已经,但迄今为止仅发现了少数非编码驱动程序。最近注意力已经转移到改变的RNA剪接在癌症中的作用。相比之下,由于表征非编码癌症驱动程序的综合挑战和snRNA基因的重复性,对剪接体非编码成分,一系列小核RNA(snRNA)的癌症相关改变的研究很少。

在这里,研究人员报告了在几种肿瘤类型中,U1 snRNA的第三个碱基处高度复发的A> C体细胞突变。U1的主要功能是通过碱基配对识别5'剪接位点(5'SS)。此突变将U1和5'SS之间的优先A-U碱基配对更改为C-G碱基配对,从而创建新的剪接点并改变了多个基因的剪接模式,包括已知的癌症驱动程序。在临床上,A> C突变与肝细胞癌(HCC)的酒精滥用和慢性淋巴细胞性白血病(CLL)的侵袭性IGHV亚型相关。
该研究证明了剪接体RNA中最早的非编码驱动程序之一,揭示了癌症中异常剪接的新机制,这可能代表了新的治疗靶标。
U1-snRNA突变驱动Shh髓母细胞瘤
癌症中的复发性体细胞单核苷酸变异(SNV)很大程度上局限于蛋白质编码基因,在大多数儿科癌症中很少见。
在这里,研究人员报道了约50%的Sonic hedgehog髓母细胞瘤(Shh-MB)中U1剪接小核RNA(snRNA)的高度复发性热点突变,该突变在其他髓母细胞瘤亚组中均不存在。在其他36种其他肿瘤类型的2,442例癌症中,发现此U1-snRNA热点突变<0.1%。婴儿Shh-MB基本上不存在这种突变,这种突变发生在97%的成年人(Shhδ)和25%的青少年(Shhα)中。
U1-snRNA突变发生在5'剪接位点结合区域,并且snRNA突变型肿瘤已显著破坏RNA剪接,并带有过量的5'剪接事件。突变的U1-snRNA介导的可变剪接使肿瘤抑制基因(PTCH1)失活,并激活癌基因(GLI2,CCND2),这是治疗的新靶点,并构成了在癌症非蛋白质编码基因的高度复发性和组织特异性突变。
SF3B1驱动黑色素瘤的进展
SF3B1是癌症中最常见的突变的RNA剪接因子,但对SF3B1突变促进恶性肿瘤的机制了解甚少。在这里,研究人员将全癌剪接分析与正富集CRISPR筛选相结合,以优先考虑促进肿瘤发生的剪接改变。

该研究发现多样的SF3B1突变在BRD9的抑制上收敛,BRD9是最近描述的非经典BAF染色质重塑复合体的核心组件,该复合体也包含GLTSCR1和GLTSCR1L。突变体SF3B1识别BRD9中的内含子分支点,从而诱导包含内源性逆转录病毒元件的毒性外显子的掺入以及随后BRD9 mRNA的降解。BRD9的消耗会导致CTCF相关基因座上非典型BAF的丢失,并促进黑色素瘤的发生。
BRD9是葡萄膜黑色素瘤中的一种有效的肿瘤抑制因子,因此使用反义寡核苷酸或CRISPR定向诱变纠正SF3B1突变细胞中BRD9的错剪,可以抑制肿瘤的生长。该研究结果暗示了非典型BAF在携带SF3B1突变的多种癌症类型中的破坏,并提出了一种基于机制的治疗方法来治疗这些恶性肿瘤。
参考信息:
https://www.nature.com/articles/s41586-019-1651-z
https://www.nature.com/articles/s41586-019-1650-0
https://www.nature.com/articles/s41586-019-1646-9
-
焦点事件

-
焦点事件

-
科技前沿

-
科技前沿