免疫缺陷动物的品种介绍
在上一期学习了疾病动物模型的基本简介,包括模型的意义,应用及分类等。免疫缺陷动物是一种先天免疫功能缺陷的动物,它的出现开创了肿瘤学、免疫学新的里程碑。同样它归属于疾病动物模型,在生命医学领域必不可少。本期内容:免疫缺陷动物。
一、免疫缺陷动物简介
概念:免疫缺陷动物(Immunodeficiency animals)是指由于先天遗传突变或用人工方法造成一种或多种免疫系统组成成分缺陷的动物。
按产生原因分类:
先天性免疫缺陷动物:又为自发性免疫缺陷动物,是指动物自然发生的免疫缺陷疾病,通过定向培育而获得的免疫功能缺陷或者低下的动物。包括裸小鼠,Beige小鼠,Xid小鼠,SCID小鼠,NOD/SCID小鼠,BNX小鼠。
获得性免疫缺陷动物:又为诱发性免疫缺陷动物,是指采用人工方式干预使其免疫功能缺陷或者低下的动物,主要是转基因的免疫缺陷动物。如AIDS模型,免疫抑制等模型。
按免疫缺陷程度分为:
T淋巴细胞缺陷:如裸鼠
B淋巴细胞缺陷:如XID小鼠
NK细胞缺陷:如Beige小鼠
联合免疫缺陷动物:如T、B淋巴细胞缺陷的小鼠(SCID、Nod-scid小鼠)
二、免疫缺陷动物的发展史
1. Nude小鼠,1966年(Flanagan, 1966)
科学家首次发现在C57BL/6品系中的Foxn1基因突变会导致胸腺上皮细胞发育异常,表现出没有毛发,且致使血液中缺乏T细胞,小鼠免疫力显著降低,但NK细胞活性增强,体液免疫能力正常,导致人类造血干细胞无法移植。可用于人类肿瘤及各种免疫缺陷疾病的研究。

2. CB17-scid小鼠,1983年(Bosma, Custer, & Bosma, 1983)
1983年科学家发现在CB17小鼠品系中的Prkdc突变首次让人类PBMCs能够在该小鼠品系中的移植得以极低水平的存活,但无法重建人类免疫系统。后续研究发现CB17-Scid缺乏成熟的T细胞和B细胞,但依然存在很高的NK细胞活性和固有免疫力,导致造血人类干细胞无法移植,该品系还是难以成为好的人源化小鼠模型。
3.Nod-scid小鼠,1995年(Shultz et al., 1995)
偶然的机会Shultz发现将scid突变小鼠和Non-obesediabetic(NOD)小鼠杂交后出生的NOD-scid小鼠能够支持更多人类PBMCs或者造血干细胞移植的生长,后续研究发现该杂交品系抑制了NK细胞的活性,并且还伴随有固有免疫系统的缺陷。该品系成为近20年应用最广的重症免疫缺陷型小鼠,并且和众多不同品系杂交产生了更多的亚型小鼠。
4. IL2rg小鼠,1995年(Cao et al., 1995; DiSanto, Muller, Guy-Grand, Fischer,& Rajewsky, 1995)
1995年,数个独立的实验室报告了IL-2Rγ-chain基因位点的突变会导致小鼠淋巴系统发育不良。IL-2Rγ-chain是细胞因子IL-2,4,7,9,15和21受体的至关重要的组成部分,而其突变将导致这些细胞因子的信号传导受阻,使得NK细胞发育严重受阻,且T细胞和B细胞的功能也受到极大的破坏。在后面数年中进一步得到了IL2rg-/-小鼠,在此小鼠中人类造血干细胞和PBMCs的移植变得容易了很多。
5. Rag1-/-和Rag2-/-小鼠,2000年(Shultz et al., 2000; Traggiai et al., 2004)
科学家发现Rag1基因敲除后,小鼠体内的V(D)J重组丧失,T和B淋巴细胞分化、发育被完全阻断,使得小鼠血液中T细胞和B细胞丧失了正常的功能,引起一类严重的联合免疫缺陷,同样的表型在Rag2突变小鼠中也发生了。
三、免疫缺陷型动物家族图谱
当下生物医药研究中大部分人源化动物模型,都是由以上五类免疫缺陷型动物相互杂交产生的(如下图),不同的杂交基因型具备不同的属性,适用于不同的适应症研究。
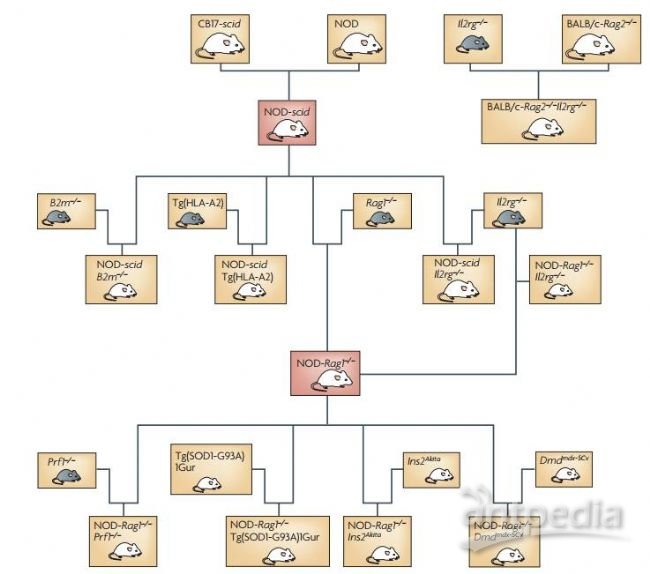
在四个大的研究领域,肿瘤学,免疫学,人源化肝脏和感染性疾病,实验所用到的动物模型全部来自于以上图谱。
四、部分重要免疫缺陷动物及其发展方向
1. 其中最受关注的便是NRG小鼠(Rag2,IL2rg双敲小鼠),普遍认为是当今免疫缺陷程度最高的动物模型。将可诱导的uPA系统引入该品系,生产出URG小鼠,据研究人员表示,URG足以媲美FRG小鼠,可以重建最高80%的人类肝脏组织,用来研究HBV和HCV感染,以及药物毒性和代谢过程。大鼠具有更加明确的质量标准并可以提供足够的血液便于实验操作,邦耀实验室利用CRISPR/Cas9技术研发的NRG大鼠已应用于感染疾病及药物代谢的研究。

2. NRG与Fah-/-小鼠杂交获得的FRG小鼠成为了人源化肝脏研究领域最重要的模型,利用这个模型,使得我们研究得以研究肝脏纤维化疾病,肝脏代谢性疾病,药物代谢途径,肝脏肿瘤疾病,人类寄生虫(疟疾)和感染性疾病。邦耀实验室目前已经成功构建出FRG大小鼠,已经开始应用于肝脏相关疾病的研究。
3.NOD-scid小鼠与IL2rg-/-杂交所得的品系NOG(NOD/Shi-scid,IL-2Rγnull)小鼠,与NOD/scid小鼠相比,NOG小鼠的人体细胞和组织移植存活率显著提高,同时能够植入更高比例的正常或癌变人类细胞和组织。另外,NOG小鼠还能满足作为人类免疫系统模型的需求,植入人类造血干细胞后,NOG小鼠的外周淋巴组织可以产生人类T细胞。
五、免疫缺陷型动物应用领域
1. 肿瘤学研究:肿瘤生长、肿瘤转移、肿瘤复发及抗肿瘤药物筛选等研究。其中BALB/cNude小鼠在建立异种移植瘤模型较常见。裸大鼠没有胸腺,缺乏T细胞,裸大鼠可为常规血液学和血清生物化学分析实验提供足够的血样。
2. 免疫系统研究:免疫缺陷动物由于免疫功能缺陷因此可以用于免疫系统中如T细胞、B细胞、NK细胞及免疫相关疾病的研究,并且BALB/cNude还可以制备高效多产的单克隆抗体。
3. 肝脏研究:主要是指肝脏再生功能,药物代谢及肝脏相关疾病研究。
4. 感染性疾病:因为缺陷动物对环境细菌和病毒敏感,是研究病毒、细菌感染的很好的动物模型。
参考文献:
Flanagan, S. P. (1966). 'Nude',a new hairless gene with pleiotropic effects in the mouse. Genet Res, 8(3),295-309.
Bosma, G. C., Custer, R. P.,& Bosma, M. J. (1983). A severe combined immunodeficiency mutation in the mouse. Nature, 301(5900), 527-530.
Shultz, L. D., Schweitzer, P.A., Christianson, S. W., Gott, B., Schweitzer, I. B., Tennent, B., . . . et al.(1995). Multiple defects in innate and adaptive immunologic function in NOD/LtSz-scid mice. J Immunol, 154(1), 180-191.
Cao, X., Shores, E. W., Hu-Li,J., Anver, M. R., Kelsall, B. L., Russell, S. M., . . . et al. (1995).Defective lymphoid development in mice lacking expression of the common cytokine receptor gamma chain. Immunity, 2(3), 223-238.
DiSanto, J. P., Muller, W.,Guy-Grand, D., Fischer, A., & Rajewsky, K. (1995). Lymphoid development in mice with a targeted deletion of the interleukin 2 receptor gamma chain. ProcNatl Acad Sci U S A, 92(2), 377-381.
Shultz, L. D., Lang, P. A.,Christianson, S. W., Gott, B., Lyons, B., Umeda, S., . . . Greiner, D. L.(2000). NOD/LtSz-Rag1null mice: an immunodeficient and radioresistant model for engraftment of human hematolymphoid cells, HIV infection, and adoptive transfer of NOD mouse diabetogenic T cells. J Immunol, 164(5), 2496-2507.
Traggiai, E., Chicha, L.,Mazzucchelli, L., Bronz, L., Piffaretti, J. C., Lanzavecchia, A., & Manz,M. G. (2004). Development of a human adaptive immune system in cord blood cell-transplanted mice. Science, 304(5667), 104-107. doi:10.1126/science.1093933




















