一种基于CRISPR-Cas9 的新型诱导谱系示踪技术
通常情况下,是癌症的转移而非原发病灶导致了癌症患者的死亡。转移不单是由遗传驱动的,这表明其他水平的失调可能也是癌症转移的推手。目前的方法无法同时捕获每个分析细胞的分子表型,这限制了人们对不同转移性克隆的研究。
前瞻性谱系示踪方法,例如慢病毒条形码,它涉及用独特的 DNA 条形码标记细胞。然而,这种“静态”条形码策略通常仅限于在体外和单个时间点引入多种标签。因此,它们无法在体内捕获关键的过程。
2021年6月10日,来自美国宾夕法尼亚大学的研究团队在 Cancer Cell 期刊发表了题为:Single-cell lineage tracing of metastatic cancer reveals selection of hybrid EMT states 的研究论文。
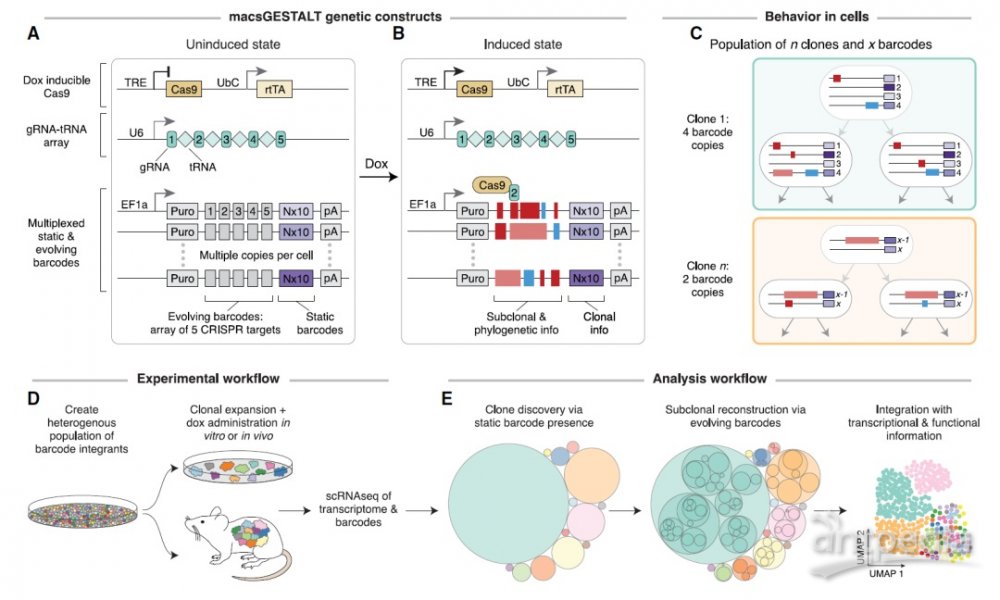
该研究开发了一种基于 CRISPR-Cas9 的新型诱导谱系示踪技术—macsGESTALT。该技术可高效捕获单细胞转录和系统发育信息。通过将此技术应用于胰腺癌小鼠模型,能够根据细胞的转移程度对细胞进行排序,然后将这些行为差异与基因表达变化联系起来。表明不仅基因突变可以推动癌症的扩散,基因表达模式在癌症预后中也起着关键作用。
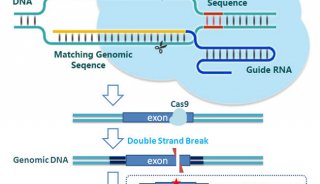
为了以高分辨率研究癌症转移,研究团队开发了一种新技术,他们使用 CRISPR/Cas9 来诱变合成引入的 DNA 序列,作为细胞条形码。然后将这些工程化的癌细胞注射到小鼠体内并使其转移。当癌症在宿主小鼠中发展和扩散时,细胞条形码被 CRISPR/Cas9 随机“编辑”。因此,这种条码编辑模式可用于重建癌细胞的系统发育树。
研究团队观察了两只小鼠多个器官的大约 28000 个癌细胞,他们能够看到随着癌症从胰腺扩散到其他器官和组织,每个细胞都开启了哪些基因。他们还追踪了细胞在体内分布的位置,以查看特定谱系是否比其他谱系更容易发生转移。
当研究团队检查这些数据时,他们惊讶地发现大约一半的克隆或不同的癌细胞群仅限于原发肿瘤。当他们查看已经扩散的克隆时,他们发现每只小鼠中只有一个优势克隆。
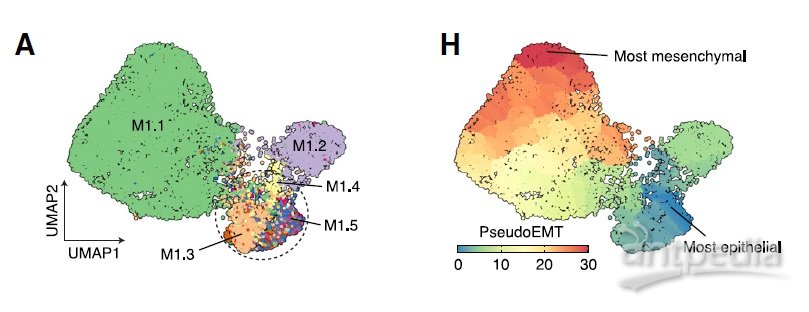
转移灶中的这一优势克隆以及从原发肿瘤扩散的其他克隆的转录组谱彼此不同,并且与局限于原发肿瘤的克隆不同。来自这个侵袭性克隆的基因表达数据显示,它开启了与所谓的上皮间质转化(EMT)相关的基因,该过程被认为赋予癌症侵袭性。
在整个克隆中,研究团队发现细胞在 EMT 谱中占据不同的位置,从表达许多上皮基因到表达许多间充质基因。这些细胞存在于一个连续的 EMT 状态中。
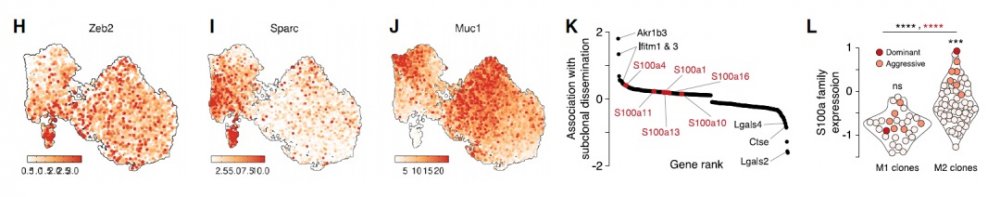
更具攻击性的细胞的遗传特征与人类癌症相关的基因有很多匹配,其中一些预测存活率降低,突出了它们与临床疾病进展的相关性。
研究团队还发现,在来自第二只小鼠的一个特别具有攻击性的克隆中,与其他克隆相比,与癌症特性(例如细胞迁移和进出血管的能力)相关的基因家族显著过度表达。这些基因家族的表达在不同的群体中传播,并增强了在可能与 EMT 互补的过程中转移的能力。
总的来说,macsGESTALT 技术非常适合以高分辨率研究癌症转移,因为它具有可诱导性,允许谱系追踪在肿瘤植入后启动。macsGESTALT可以与 scRNA-seq 相结合,轻松适应任何可工程化的基因小鼠模型,以实现谱系追踪,助力科学家找到实现癌症转移的保守和独特因子。
-
技术原理