Nature子刊两连发,重磅揭秘CAR-T疗法毒性控制机制!
近年来,CAR-T疗法经改良后已在急性白血病和非霍奇金淋巴瘤的治疗上呈现显著的疗效,被认为是目前最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术的进步也需经历一个漫长的演化过程,而毒性反应已成为其发展道路上的拦路石,不克服则难以前行,这也成为该领域的机遇,谁能率先拔得头筹,就能抢占先机。

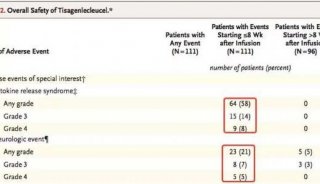
目前,CAR-T疗法最令人如鲠在喉的毒性反应就是细胞因子释放综合征(CRS)和神经毒性。CAR-T细胞输注到体内后,可发生嵌合抗原受体与相应的肿瘤相关抗原的特异性结合,引起CAR-T细胞的激活和增殖,诱发细胞因子级联释放,介导多类免疫反应,最终导致发热、低血压、呼吸困难、凝血障碍、终末器官障碍等临床表现,这就是CRS。
有报道称CAR-T神经毒性可并发于CRS,也可独立于CRS。临床表现有头痛、意识模糊、认知改变、幻觉、言语障碍、共济失调、失用症、面神经瘫痪、震颤、辨距障碍和癫痫等。这两种毒性反应严重制约了CAR-T疗法的发展。
5月28日,《Nature Medicine》连发两文,重磅揭示CAR-T疗法毒性反应的发生和控制机制!来自意大利和美国的两个研究小组通过两项独立小鼠模型的相关实验证明IL-1、IL-6受体抑制剂可有效控制CAR-T疗法的CRS和神经毒性!接下来小编为大家一一详解。
《CAR T cell–induced cytokine release syndrome is mediated by macrophages and abated by IL-1 blockade》

美国科学家Theodoros Giavridis等人发现小鼠模型在CAR-T细胞输注2-3天后即发生CRS,而CRS的严重程度并非由CAR-T细胞产生的细胞因子介导,而与巨噬细胞产生的IL-6,IL-1和一氧化氮(NO)息息相关,因此IL-6、IL-1抑制剂的应用可以有效干预CRS。
研究人员利用CRS小鼠模型辨别了不同细胞因子和趋化因子的T细胞或宿主细胞来源,除了发现T细胞源性因子外,还证明了IL-6、IL-1是由内源性小鼠细胞产生,而且T细胞源性因子在CRS细胞中缺乏活性,IL-6、IL-1等巨细胞源性因子活跃性较高,这就证实了CRS是多细胞交叉作用的结果,而不仅仅是二元肿瘤与CAR-T细胞相互作用。
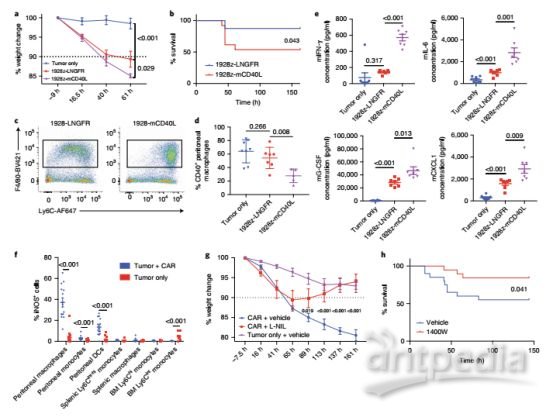
巨噬细胞功能的调节决定了CRS的严重程度
就IL-1而言,他们发现虽然T细胞能够产生IL-1,但T细胞并非是在CAR-T治疗的小鼠中发挥作用的主要细胞,而在能特异性激活巨噬细胞的CAR-T细胞中,小鼠的CRS明显恶化,当巨噬细胞活性降低时,CRS的严重程度显著降低。
IL-1可在不影响抗肿瘤功效的情况下防止严重的CRS
此后的受体-配体遗传实验,通过对肿瘤和脾脏髓样细胞的计数和表达分析,研究人员发现CRS可通过工程化的CD40-CD40L相互作用加剧复合,从而进一步证明CRS相关巨噬细胞产物(IL-6、IL-1)为介导CRS严重程度的主要介质。也就是说,阻断CRS相关巨噬细胞的IL-6、IL-1的分泌有望降低CRS的严重程度。
2. 《Monocyte-derived IL-1 and IL-6 are differentially required for cytokine-release syndrome and neurotoxicity due to CAR T cells》

意大利科学家Margherita Norelli等人建立了一个同时并发CRS和神经毒性的CAR-T疗后白血病人源化小鼠模型,他们发现人单核细胞是CRS期间IL-1和IL-6的主要来源。
因此指出可以通过阻断单核细胞或使用tocilizumab(IL-6受体单克隆抗体注射剂)阻断IL-6受体,从而防止CRS,但其对神经毒性作用不足,而IL-1受体拮抗剂anakinra消除了CRS和神经毒性,显著延长了患者的无白血病存活期。这些发现神经毒性的治疗提供了新策略,开辟了更为安全的CAR-T治疗篇章。

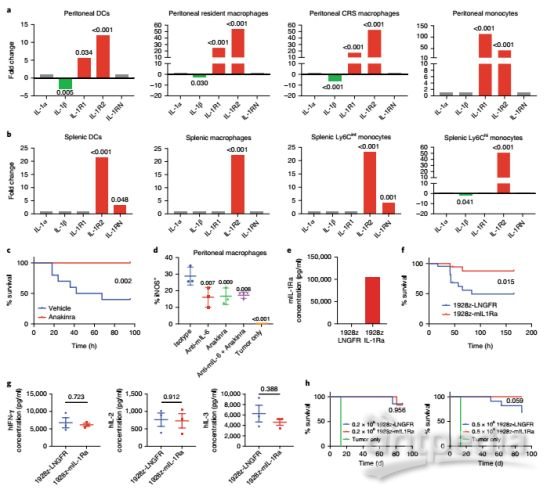
单核细胞消融可保护小鼠免于CRS
研究人员发现,IL-6的释放主要依赖于单核细胞。在促炎单核细胞活化的过程中,IL-1比IL-6产生的速度快数个小时。我们知道IL-1能够诱导IL-6和可溶性IL-6R(sIL-6R)的分泌,因此研究人员推测CRS可能主要由循环单核细胞释放的IL-1引发。
最终他们发现IL-1拮抗剂anakinra与IL-6受体单克隆抗体tocilizumab的作用相当,而且二者皆不会影响CAR-T对白血病的治疗效果,更可喜的是,anakinra还可有效消除神经毒性。这就说明针对IL-1的靶向干预可以成功地克服两种毒性反应,更加适用于临床预防和治疗CRS和神经毒性。

anakinra可消除神经毒性
但是,必须注意的是,这两项研究皆是在小鼠模型上进行,小鼠的身体机能和免疫系统终归与人体有一定程度的不同,因此在临床应用方面需要谨慎,目前还需要更为严谨的临床验证,我们静待佳音。
-
焦点事件