Nature:新型抗生素发现中的“追本溯源”式合成
病原菌的进化与抗生素的发现,是一场事关无数人类的生死竞赛。上世纪青霉素的发现,开启了β-内酰胺类抗生素对当时常见病原菌的辉煌胜利,但细菌随之进化出了各种对应性极强的耐药机制,比如金属β-内酰胺酶来水解常用的β-内酰胺类抗生素,使其丧失战斗力。由于人类对抗生素的滥用,对多种常用抗生素都有耐药性的“超级细菌”随后出现,其中多重耐药(MDR)革兰氏阴性菌的威胁尤其严重。根据联合国的有关预测,除非开发出新型抗生素,否则多重耐药性感染将在未来十年内迫使多达2400万人陷入极端贫困,到2050年甚至将可能导致每年1000万人死亡。
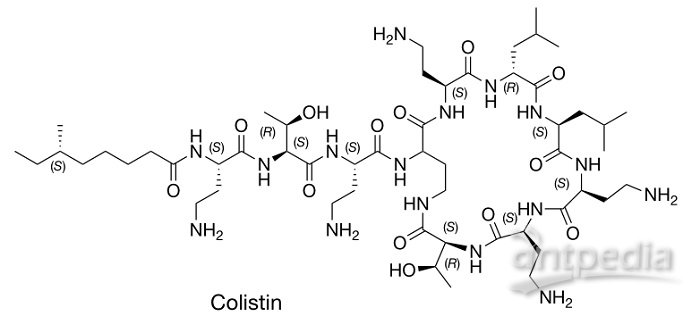
“最后防线”——粘菌素结构图。图片来源:Nature
来自土壤细菌的粘菌素(colistin)对不少多重耐药菌株有抑制作用,因此被称为“最后防线”。与许多天然产物抗生素一样,粘菌素是结构相关代谢物集合的一部分,这些代谢物由进化相关但不同的生物合成基因簇(BGC)编码。具体来说,粘菌素属于多粘菌素(polymyxin)类,这类抗生素是一大类阳离子环状脂十肽,由类芽孢杆菌基因组中的非核糖体肽合成酶BGC 产生。遗憾的是,随着粘菌素在畜牧业中的广泛使用以及在人类抗菌治疗中的频繁出场,临床上能够突破这道防线的菌株越来越多。病菌的粘菌素耐药性还有另外一个糟糕的特点——传播迅速,部分原因是可转移粘菌素抗性(mobilized colistin-resistance)基因 mcr-1,这个编码磷酸乙醇胺转移酶的基因在质粒上,可以轻松地在细菌之间转移,干扰粘菌素与细菌的相互作用。
病原菌会进化,那么产生粘菌素的细菌会不会进化?在自然界中,细菌也需要不断地争夺生存资源,不断发展新策略来抑制邻近菌株的生长。粘菌素来自土壤细菌,目的是消除竞争对手,如果竞争对手通过获取 mcr-1 来抵抗攻击,那么产生粘菌素的细菌随后也完全可能继续进化,从而产生能够杀死 mcr-1 细菌的新型抗菌素。这一点估计很多圈内的小伙伴都能够想到,接下来的常规操作就是在实验室中培养细菌,激活相关BGC的表达,分离化合物,进行药物活性评估。这些说着容易,但做起来都很难,细菌能不能在实验室条件下培养?这么多不同的BGC,如果一个一个的试一遍要花多久?BGC在工程菌中能不能激活表达?化合物是否容易分离?想想都头痛……
近日,洛克菲勒大学Sean F. Brady团队发展了一种“追本溯源”式合成策略,巧妙地解决这个难题。他们没有在实验室中培养细菌并分离天然产物,而是直接在细菌基因组中寻找相应的基因,预测其天然产物结构,随后进行化学合成。具体来说,他们基于生物信息学算法筛选了上万个细菌基因组,发现了35组BGC有可能编码多粘菌素类抗生素,并且预测其中一组BGC可能编码结构不同的粘菌素同系物。进一步分析该BGC,该团队预测了这种新分子的结构,并将其命名为macolacin,并通过化学合成获得了该化合物。实验结果表明,macolacin这种合成生物信息天然产物(synthetic bioinformatics natural product, syn-BNP)不但对表达 mcr-1 的革兰氏阴性病原菌有抑制活性,而且对于具有染色体编码磷酸乙醇胺转移酶基因的内在抗性病原菌也具有活性,这些革兰氏阴性菌包括对人类极具威胁的广泛耐药的鲍曼不动杆菌和对粘菌素具有内在耐药性的淋病奈瑟菌。相关论文发表于Nature 杂志。
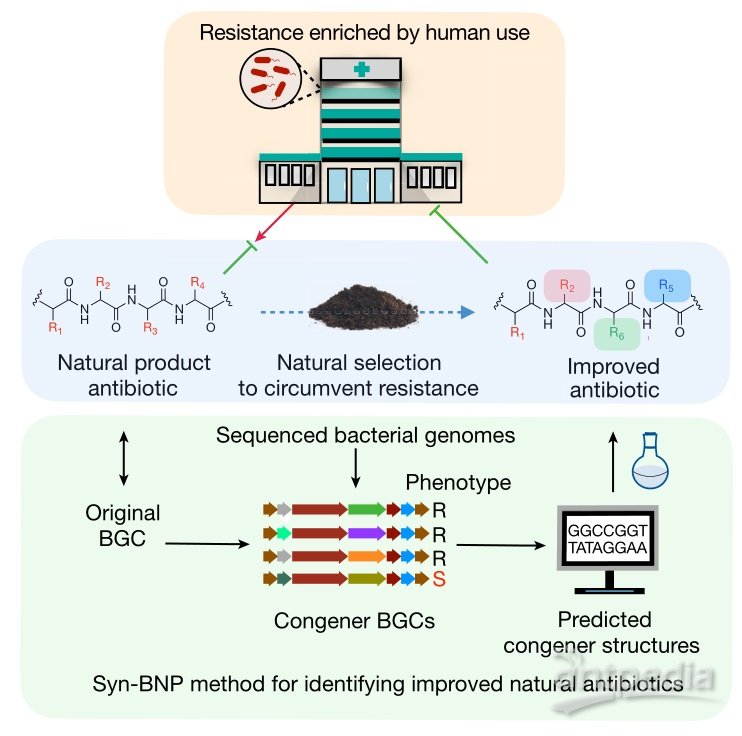
Syn-BNP方法鉴定新型天然抗生素。图片来源:Nature
为了系统地识别天然存在的多粘菌素家族成员,他们基于生物信息学分析筛选了10,858 个细菌基因组,发现了35组BGC有可能产生类似多粘菌素/粘菌素的分子结构,其中一组被称为mac 的BGC,其编码的分子结构预计与粘菌素差别很大,这意味着有可能获得结构不同的粘菌素同系物。为了获得 mac BGC 的预测产物,该团队使用固相合成法来合成生物信息学预测的线性十肽,然后用 (S)-6-甲基辛酸将其 N-末端酰化,再通过位置 4 的 Dab的环化和去保护得到 macolacin。
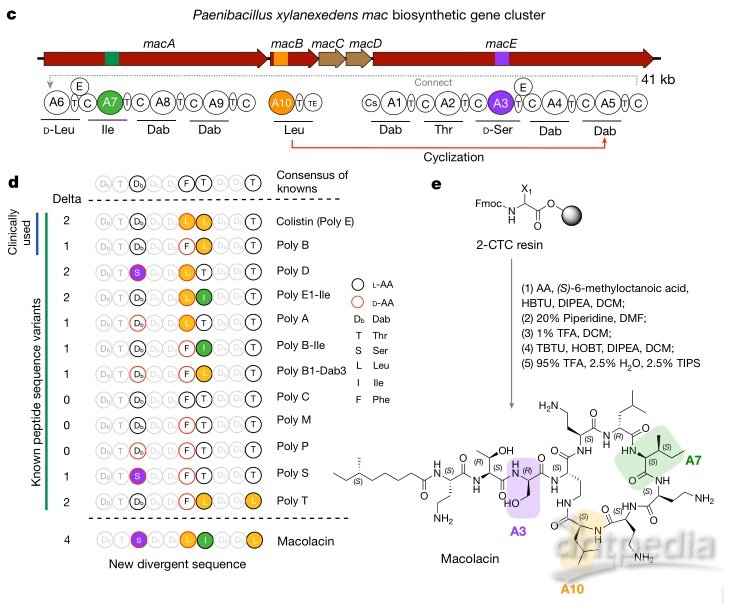
相关生物合成基因簇、macolacin预测结构及化学合成。图片来源:Nature
在实验中,macolacin 被证明对多种类型的粘菌素耐药菌有效,包括具有内在耐药性的淋病奈瑟菌以及广泛耐药的鲍曼不动杆菌,这些都是对人类威胁极高的病原体。
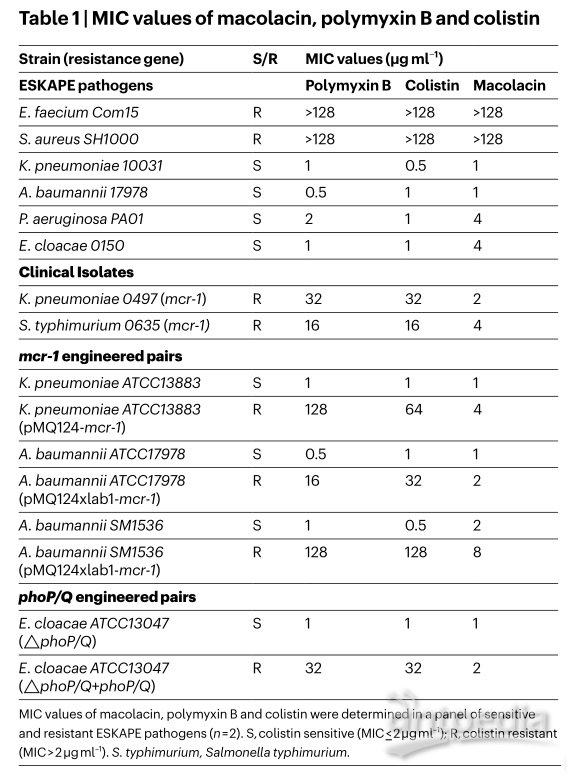
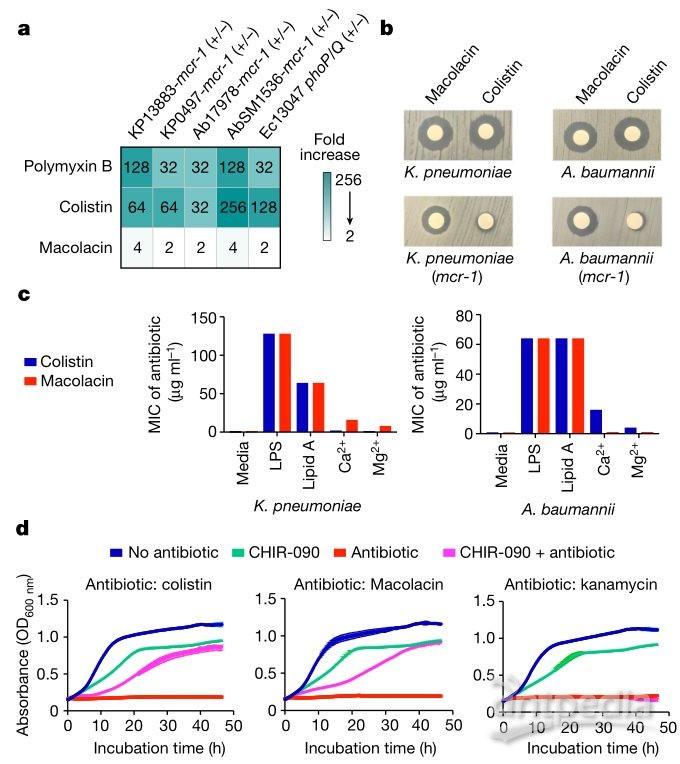
小鼠实验中,macolacin的联苯类似物也表现出了类似抗菌活性。
在另一项研究中,Brady团队使用类似的方法发现了另外一类新型抗生素(Nat. Microbiol., 2022, 7, 120–131),称为甲基萘醌结合抗生素(MBA),以在细菌电子传递中起关键作用的甲基萘醌为靶点。这类抗生素可抑制耐甲氧西林金黄色葡萄球菌——另一种危险的多重耐药菌。该团队表示,这种用于发现 macolacin 的基于进化的基因组挖掘方法,也可以应用于解决其他耐药菌问题。
面对多重耐药病菌的“魔高一尺”,期待这种新方法能为人类带来“道高一丈”的制胜武器。
-
仪器推荐

-
仪器推荐

-
仪器推荐

-
仪器推荐

-
仪器推荐

-
焦点事件

-
科技前沿

-
项目成果
-
项目成果

























