亲和层析(Affinity Chromatography)(3)
⑥元素分析:如果配体中含有某种特别的元素,通过元素分析就可以确定配体结合量。
⑦放射性分析法:偶联中加入一定量带有同位素的配体,通过放射性分析确定配体结合量,这是一种非常灵敏的方法。
影响配体结合量的因素很多,包括基质和配体的性质、基质的活化方法及条件、基质和配体偶联反应的条件等等。例如通常溴化氰活化的基质的活性基团比环氧基活化的基质多,配体结合量可能较大。在用溴化氰活化时,增加溴化氰的量及反应的pH,可以增加基质上活化基团的量,从而增大配体结合量。偶联过程中增加配体的量及增大反应的pH,也可以增大配体结合量。实验中通常希望配体结合量较高,但应注意增加配体结合量应根据实际情况,还要考虑到其它因素的影响。因为提高配体的结合量不等价于提高亲和吸附剂的吸附容量,配体结合量只是影响亲和吸附剂吸附容量的一个因素,还有很多因素,如基质、配体以及待分离物质本身的性质,配体在基质的结合情况以及后面要介绍的实验操作条件等都可能对亲和吸附剂的吸附容量产生很大的影响。例如增大配体的结合量通常可以增加吸附容量,但有些增大配体结合量的条件可能会影响配体的结构,降低配体和待分离物质的亲和力,这样反而会降低亲和吸附剂的吸附容量。实际影响亲和吸附剂吸附容量的因素是非常复杂的,各种因素的影响都不是绝对的,要获得较高的吸附容量往往要考虑很多因素,并通过实验摸索来选择合适的条件。
目前已有多种活化的基质以及偶联各种配体的亲和吸附剂制成商品出售,可以省去基质活化,配体偶联等复杂的步骤。使用方便,效果好,但一般价格昂贵。关于这些产品的具体情况,可参阅本书后面的参考文献或相关的产品介绍。
亲和吸附剂的再生和保存
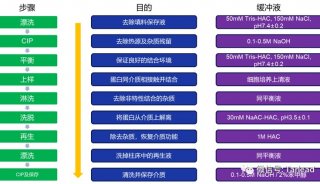
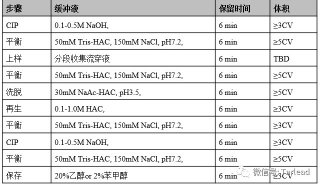
亲和吸附剂的再生就是指使用过的亲和吸附剂,通过适当的方法去除吸附在其基质和配体(主要是配体)上结合的杂质,使亲和吸附剂恢复亲和吸附能力。一般情况下,使用过的亲和层析柱,用大量的洗脱液或较高浓度的盐溶液洗涤,再用平衡液重新平衡即可再次使用。但在一些情况下,尤其是当待分离样品组分比较复杂的时候,亲和吸附剂可能会产生较严重的不可逆吸附,使亲和吸附剂的吸附效率明显下降。这时需要使用一些比较强烈的处理手段,使用高浓度的盐溶液、尿素等变性剂或加入适当的非专一性蛋白酶。但如果配体是蛋白质等一些易于变性的物质,则应注意处理时不能改变配体的活性。
亲和吸附剂的保存一般是加入 0.01%的叠氮化钠,4°C 下保存。也可以加入0.5%的醋酸洗必泰或0.05%的苯甲酸。应注意不要使亲和吸附剂冷冻。
亲和层析的基本操作
亲和吸附剂选择制备后,亲和层析的其它操作与一般的柱层析基本类似。下面主要介绍亲和层析过程中的一些注意事项。
上样
亲和层析纯化生物大分子通常采用柱层析的方法。亲和层析柱一般很短,通常10cm
左右。上样时应注意选择适当的条件,包括上样流速、缓冲液种类、pH、离子强度、温度等,以使待分离的物质能够充分结合在亲和吸附剂上。一般生物大分子和配体之间达到平衡的速度很慢,所以样品液的浓度不易过高,上样时流速应比
较慢,以保证样品和亲和吸附剂有充分的接触时间进行吸附。特别是当配体和待分离的生物大分子的亲和力比较小或样品浓度较高、杂质较多时,可以在上样后停止流动,让样品在层析柱中反应一段时间,或者将上样后流出液进行二次上样,以增加吸附量。样品缓冲液的选择也是要使待分离的生物大分子与配体有较强的亲和力。另外样品缓冲液中一般有一定的的离子强度,以减小基质、配体与样品其它组分之间的非特异性吸附。
生物分子间的亲和力是受温度影响的,通常亲和力随温度的升高而下降。所以在上样时可以选择适当较低的温度,使待分离的物质与配体有较大的亲和力,能够充分的结合;而在后面的洗脱过程可以选择适当较高的温度,使待分离的物质与配体的亲和力下降,以便于将待分离的物质从配体上洗脱下来。
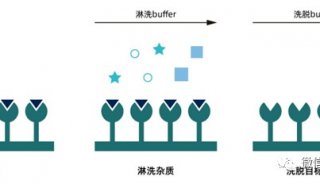
上样后用平衡洗脱液洗去未吸附在亲和吸附剂上的杂质。平衡缓冲液的流速可以快一些,但如果待分离物质与配体结合较弱,平衡缓冲液的流速还是较慢为宜。如果存在较强的非特异性吸附,可以用适当较高离子强度的平衡缓冲液进行洗涤,但应注意平衡缓冲液不应对待分离物质与配体的结合有明显影响,以免将待分离物质同时洗下。
洗脱
亲和层析的另一个重要的步骤就是要选择合适的条件使待分离物质与配体分开而被洗脱出来。亲和层析的洗脱方法可以分为两种:特异性洗脱和非特异性洗脱。
⑴特异性洗脱
特异性洗脱是指利用洗脱液中的物质与待分离物质或与配体的亲和特性而将待分离物质从亲和吸附剂上洗脱下来
特异性洗脱也可以分为两种:一种是选择与配体有亲和力的物质进行洗脱,另一种是选择与待分离物质有亲和力的物质进行洗脱。前者在洗脱时,选择一种和配体亲和力较强的物质加入洗脱液,这种物质与待分离物质竞争对配体的结合,在适当的条件下,如这种物质与配体的亲和力强或浓度较大,
配体就会基本被这种物质占据,原来与配体结合的待分离物质被取代而脱离配体,从而被洗脱下来。
例如用凝集素作为配体分离糖蛋白时,可以用适当的单糖洗脱,单糖与糖蛋白竞争对凝集素的结合,可以将糖蛋白从凝集素上置换下来。
后一种方法洗脱时,选择一种与待分离物质有较强亲和力的物质加入洗脱液,这种物质与配体竞争对待分离物质的结合,在在适当的条件下,如这种物质与待分离物质的亲和力强或浓度较大,待分离物质就会基本被这种物质结合而脱离配体,从而被洗脱下来。例如用染料作为配体分离脱氢酶时,可以选择NAD+进行洗脱,NAD+是脱氢酶的辅酶,它与脱氢酶的亲和力要强于染料,所以脱氢酶就会与NAD+结合而从配体上脱离。
特异性洗脱方法的优点是特异性强,可以进一步消除非特异性吸附的影响,从而得到较高的分辨率。另外对于待分离物质与配体亲和力很强的情况,使用非特异性洗脱方法需要较强烈的洗脱条件,很可能使蛋白质等生物大分子变性,有时甚至只能使待分离的生物大分子变性才能够洗脱下来,使用特异性洗脱则可以避免这种情况。由于亲和吸附达到平衡比较慢,所以特异性洗脱往往需要较常的时间和较大的洗脱条件,可以通过适当的改变其它条件,如选择亲和力强的物质洗脱、加大洗脱液浓度等等,来缩小洗脱时间和洗脱体积。
⑵非特异性洗脱
非特异性洗脱是指通过改变洗脱缓冲液pH、离子强度、温度等条件,降低待分离物质与配体的亲和力而将待分离物质洗脱下来。
当待分离物质与配体亲和力较小时,一般通过连续大体积平衡缓冲液冲洗,就可以在杂质之后将待分离物质洗脱下来,这种洗脱方式简单、条件温和,不会影响待分离物质的活性。但洗脱体积一般比较大,得到的待分离物质浓度较低。当待分离物质和配体结合较强时,可以通过选择适当的pH、离子强度等条件降低待分离物质与配体的亲和力,具体的条件需要在实验中摸索。可以选择梯度洗脱方式,这样可能将亲和力不同的物质分开。如果希望得到较高浓度的待分离物质,可以选择酸性或碱性洗脱液,或较高的离子强度一次快速洗脱,这样在较小的洗脱体积内就能将待分离物质洗脱出来。
但选择洗脱液的pH、离子强度时应注意尽量不影响待分离物质的活性,而且洗脱后应注意中和酸碱,透析去除离子,以免待分离物质丧失活性。
对于待分离物质与配体结合非常牢固时,可以使用较强的酸、碱或在洗脱液中加入脲、胍等变性剂,使蛋白质等待分离物质变性,而从配体上解离出来。然后再通过适当的方法使待分离物质恢复活性。