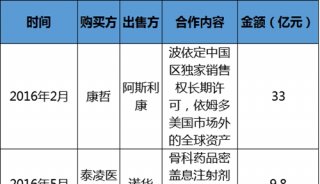
VASCEPA降低心血管事件风险适应症申请获FDA优先审评资格
VASCEPA(二十碳五烯酸乙酯,开发代号AMR101)胶囊,是经过严格的、复杂的、FDA监管的生产工艺从深海鱼中提取的高纯度EPA(二十碳五烯酸)单分子处方型产品。该产品的生产工艺可有效消除杂质并分离和保护单分子活性成分,VASCEPA?也因其独特的临床特征获得多个国际ZL,包括降低相关患者群体的甘油三酯水平而不升高LDL-C水平。
VASCEPA早在2012年被美国食品药品监督管理局(FDA)批准用于成人严重(>=500 mg/dL)高甘油三酯血症患者饮食的辅助治疗来降低其甘油三酯水平。基于2018年REDUCE-ITTM试验结果,AMARIN又于2019年3月向FDA递交了降低心血管风险的补充新药申请。
2019年5月29日,FDA已正式接受VASCEPA?胶囊用于降低心血管风险适应症的补充新药申请(sNDA),并同时授予了优先审评资格。经FDA确认的PDUFA目标日期为2019年9月28日,审评时间比预期缩短4个月。该产品由AMARIN公司生产,亿腾医药负责中国大陆以及港澳台地区的开发、商业化及供应等活动。
一旦获得批准,对于使用他汀类药物治疗后低密度脂蛋白胆固醇(LDL-C)水平得到控制,但甘油三酯水平仍然偏高的血脂异常患者,VASCEPA?将成为首个FDA获批的能有效降低残余心血管事件发生风险的药物。
FDA授予优先审评资格并最终获批的药物,通常较于重疾的现有标准治疗手段,在有效性和安全性方面都有着显着优势。通常情况下,心血管药物获得FDA优先审评资格的情况非常罕见。此次FDA接受了VASCEPA?的补充新药申请并授予了优先审评资格,可能会使该药引领心血管疾病领域预防治疗的变革。若VASCEPA?的扩展适应症获批,将惠及数百万已接受他汀类药物治疗但仍伴有残余心血管事件发生风险的患者。
-
项目成果
-
焦点事件

-
企业风采