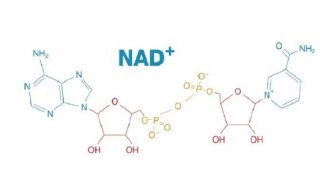
Science新成果颠覆蛋白质经典学说
然而教科书有可能不得不改写。Rohit Pappu和他的两位同事在9月20日《科学》(Science)杂志上的一篇perspective文章中,揭示了一大类没有遵循结构-功能范例的蛋白质。这些所谓的内在无序蛋白质无论整体或部分均不能折叠,但它们是具有功能的。
近期我们坐下类与圣路易斯华盛顿大学生物系统工程学中心的主任、生物医学工程学教授Pappu博士一起追踪了这一最新的科学。
有多少比例的蛋白质是内在无序的?
它由领域而定。因此在细菌和原核生物中这些数量相当小。它们大约占蛋白质组的5%。但是如果你转到真核生物或多细胞生物体,那么数量可达到整个蛋白质组的30%或40%。
但是如果你问多少比例构成信号蛋白质组(忙于将信号传给其他蛋白的蛋白质)的序列是内在无序的,那么其数量则高达60-70%。
似乎存在一种职责分工。结构蛋白参与了催化和运输。内部无序蛋白对于信号传导和调控是非常重要的。
为什么是无序蛋白参与了信号传导与调控?
我认为有两个逻辑原因。一个是因为与内在无序蛋白相关的复合物是短期存在的,另一个是因为它们通常结合多个而非一个分子。
如果一个分子除了在复合物情况下不能折叠,那么用于折叠的部分能量必定是来自分子间的相互作用。且如果这种分子取得的是能量贷款,那么形成复合物将不会是很稳定或是长期存在的。
你正将高特异性(因为只有当蛋白质识别与它形成复合物的分子时才会折叠)与低整体亲和力(因为复合物不稳定)结合到一起。
这些多对一的相互作用产生是因为无序蛋白常常通过短氨基酸链而非大的蛋白质与蛋白质界面发挥功能。因此单一的多肽链能够与多个靶标相互作用。一个模体与一个蛋白质对话,第二个模体与另一个蛋白质对话,然而通过这条链它们能够彼此沟通。
这就是为什么这些分子碰巧处在网络中心的原因。它们通过网络传输信息就像机场中心的空中交通指挥塔台一样。由于它们大部分的功能是通过这些非常小的模体来实现,它们能够协调在自然界大量不同的信息。你使得所有的事情在同一时间发生。
就你的观点,对于我而言值得注意的是你强调了这些蛋白质的功能性。这个名字是不是有点令人误解?
你说得对。随着我们对它们的了解加深,我们认为我们本应该将无序蛋白称作分子变阻器。对于物理学家而言,无序只是意味着热量波动是占主导的,因此对于物理学家来说这是一个准确的描述。问题在于在生物医学领域无序这个单词已被指定为疾病。
你提到这些蛋白使出高招的一些伎俩。其中我认为很聪明的一个是调节了局部的化学环境来促进特殊反应。
这是一个非常重要的概念。如果你正在试管中做化学试验,你想使一种反应进行,你要提高反应物的浓度:A需要碰撞B,而且经常这样做。但这是个概率问题,因此你有可能需要大量的A分子和许多的B才能获得一些统计学数字。
但如果A与B之间存在一条系绳,确保彼此经常相互碰撞。你或许用少数并非大量的分子就可以了。
这一宽松的系绳,实际上,提高了A环绕B的浓度,且这一系绳往往是一个无序区域。