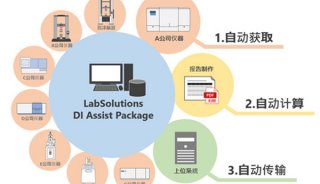
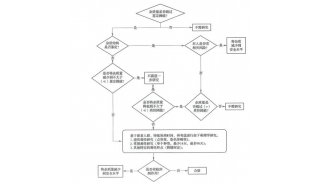
中国制药行业期待完整的药品安全链条
概括地讲,GLP内容主要包括人员、仪器设施、标准、实验系统、文件和质量保证体系五个方面的内容。GLP的适用范围包括人用药品、农药、兽药、食品添加剂、饲料添加剂、医疗器械和工业化妆品、人用医疗器械、生物制品。GLP要求实验研究工作要有计划地按照实验标准操作规程和实验计划书的内容实施,及时、准确、清晰地记录研究的过程和结果,并根据实验结果准确完整地总结实验报告。同时,在整个研究过程中,所有研究行为都要受到质量保证部门的监督、检查和审核。
经济合作与发展组织(OECD)作为发达国家政府间的国际经济协调组织,也在很大程度上推动了GLP的发展。为了避免化学品的非关税壁垒,推动非临床安全性评价数据的相互承认,同时降低不必要的重复实验的成本。OECD从国际贸易的角度出发,于1974年成立了GLP专家组,着手制订OECD的GLP标准。1981年,OECD理事会通过了“化学品评价数据相互认可的决议,正式建议在OECD各成员国实施OECD制定的GLP。OECD制定的GLP原则规定:”凡是需要登记和认可管理的医药、农药、食品和饲料添加剂、化妆品、兽药和类似产品,以及工业化学品,在进行非临床人类健康和环境安全试验时,都应当遵循GLP原则。”目前,OECD的GLP原则已为国际所广泛接受。在国际上,有的国家和组织已在统一执行相同的GLP,如OECD制定的GLP;也有的国家同时存在几个GLP,如FDA和EPA(美国环境保护局)分别就各自的监管领域公布了各自的GLP。
自美国FDA于1976年正式实施GLP以来,至今已有70多个国家和地区相继制定并推行了GLP规范。目前,GLP已成为国际上新药安全性研究实验室共同遵守的法规,也是新药进入国际市场和新药登记注册所必须遵循的准则。随着GLP规范被广泛采用,它所涉及的范围已扩大到整个药学、药效学研究领域。可以说,全球所有的非临床实验研究(质量控制、化学检测、分离提取、药理实验等)都在努力遵循其管理原则,或正逐步向GLP规范靠拢。