细胞的离心分离基础和分离实例(四)
例2. 从人血中分离红细胞,单核(白)细胞,中性(白)细胞 i. 新鲜人血(3~5)ml 用抗凝剂处理。 ii. 15ml 离心管中先注入5ml 分离液Polymorphprep(Nycomed Pharma A/S 公司产品), 然后铺上用抗血凝剂处理过的人全血5ml 。 iii. 台式低速离心机,甩平转头,450g(1500~1600rpm)×35 分钟,18℃~23℃。 iv. 分离结果:离心管上部近40%液柱为血浆,接下来一薄层为单核细胞再下面间隔了少量分离液后又是一薄层中性(白)细胞,再往下近30%液柱为分离液,红细胞在底部(沉淀)。 注意:温度过高,或离心力过大,或离心时间过长都可能使中性(白)细胞沉淀。 表:用于人血细胞分离纯化的各种商品分离液(摘自文献1)
| 名称 | 成分 | 用途 | 生产商 |
| Lymphoprep | 9.6%Na-metrizoate, 5.6% Ficoll | 单核细胞分离 | Nycomed-pharma |
| Ficoll-page | 9.6 Na-diatrizoate 5.6% Ficoll | 单核细胞分离 | Pharmacia-Biosy-st ems |
| Nycoprep 1.077 | 14.1% Nycodenz 0.44% Nacl | 单核细胞分离 | Nycomed-pharma |
| Nycoprep mixer | 19.0% Nycodenz 0.2% Nacl | 单核细胞分离 | Nycomed-pharma |
| Nycoprep 1.068 | 13.0% Nycodenz 0.58% Nacl | 单核(白)细胞淋巴细胞分离 | Nycomed-pharma |
| Nycoprep 1.063 | 12.0% Nycodenz 0.58% Nacl | 血小板分离 | Nycomed-pharma |
| Mono-poly Resolving medium | 15.5% Na-diatrizoate 8.18% Ficoll | 多形核细胞分离 | Flow-Laboratories |
| Polymorphprep | 13.8% Na-metrizoate 8.0% Dextran 500 | 单核细胞中性白细胞红细胞分离 | Nycomed-pharma |
(2) 用等密度离心法分离肝细胞:
肝细胞的离心分离在整个细胞纯化工艺中具有典型性。以鼠肝为例,每克鼠肝中有1.1 ×108 个肝主质细胞(Parenchymal);107 个肝星形细胞(Kupffer cell),2×107 个内皮细胞和1.6×107 个储脂细胞。
对这些肝细胞的分离纯化,研究人员多年来做了大量实验研究,下面概述一些典型离心分离实例:
例3:肝细胞的连续密度梯度分离
离心分离工艺需要下列基本设备,化学品和溶剂:
l 带有电磁搅拌器或旋翼搅拌器的密度梯度制备仪;
l 蠕动泵,硅胶管(内径1~1.5mm,外径3mm 左右),有些商品的自动梯度制备和收集(如日立DGF-U)本身就带有蠕动泵,硅胶管;
l 带有恒温装置的阿贝折射仪;
l 带水平转头的低温,低速离心机(台式、落地均可);
l 离心管,最好是15ml corex 玻璃离心管;
l 平衡盐溶液GBSS,配置如下:Nacl(8,000mg/l);KCL(370mg/l);Mg SO4·7H2O
(70mg/l);NaH2PO4·2H2O(150mg/l);Cacl2·2H2O(220mg/l);NaHCO3(227mg/l);
KH2PO4(30mg/l);Mgcl2·6H2O(210mg/l);葡萄糖(1,000mg/l);调节到PH7.4;
渗透压275~285mOsm,消毒过滤后储存于4℃;
l 28.7%(W/V)Nycodenz 或者30%(W/V)metrizamide 在无Nacl GBSS 中,渗透压285 mOsm, PH7.4;
l 窦状肝细胞(制备方法参见文献1,P313 或其他文献);
l 0.5%(W/V)台酚蓝(trypan blue )在生理盐水中;
l 制备过氧化物酶染色需要的条件(参见文献10)
分离方法:
i. 从一个鼠肝中制备(2~3)×106 个肝窦状细胞;
ii. 细胞在15ml GBSS 中洗三次;
iii. 低速离心300g(1200~1300rpm)×5 分钟,室温;
iv. 沉淀用6ml GBSS 制成悬液;
v. 制备梯度液和离心分离:
l 将30%(W/V)metrizamide 或28.7%(W/V)Nycodenz(最好是Nycodenz,因为它可 以高温灭菌)分别用GBSS 稀释到20%和19.1%-溶液A
l 用溶液A(metrizamide)(3.1 倍体积)稀释iv 细胞悬液,成为8%(W/V)metrizamide 梯度液或用溶液A (Nycodenz)(5.4 倍体积)稀释iv 悬液,成为7.7%(W/V)Nycodenz 梯度液
l 制备8%~20%metrizamide 或7.7%~19.1%Nycodenz 连续线性梯度(用本讲座中所用各种方法或利用Hitachi DGF-U)
l 用甩平转头,低温,低速离心机,2,000g(约3,400~3,500rpm)×30 分钟,4℃,
慢加速,慢减速。为了避免细胞聚集,总离心时间不要超过45 分钟。
Vi. 结果分析
l 用DGF-U,上取法将每个离心管中溶液分部收集成25~30 管(每管0.3~0.5ml)
l 用阿贝折射仪测定各管的折射率(RI)并换算成密度
Nycodenz:密度(g/ml)=RI×3.242-3.323 metrizamide:密度(g/ml)= RI×3.453-3.601
l 用0.5% Trypan 蓝溶介在生理盐水中与分部收集的细胞液混合,被染色的细胞为无活力细胞。
l 测定细胞数量并计算有活力的细胞百分比
l 用过氧化物酶染色反应测定肝星形细胞、内皮细胞及其他细胞的分布情况。
l 过氧化物染色反应:
a:分别取每个分部收集液数滴(约5×105 各细胞)滴入2ml 细胞培养液
培养液:15mg DAB(Merck 公司产)溶于15ml 含7%(W/V)蔗糖的0.05M Tris-HCL(PH7.4 , 300 mOsm 中再加入10 30%H2O2,
注意:30 分钟内用完。
b:在培养箱中37℃培养30 分钟(也可以用恒温水槽)
c:培养后低速离心300g×3 分钟,去上清沉淀用200μl GBSS 稀释
d:用血细胞计数器测定染色细胞数量:红细胞被染后呈黑色,而肝星形细胞(Kupffer)
呈深褐色,由于它们大小不同,颜色也可分辨,在计数器上很容易鉴别。内皮细胞和
淋巴西哦保保持染色前原色。
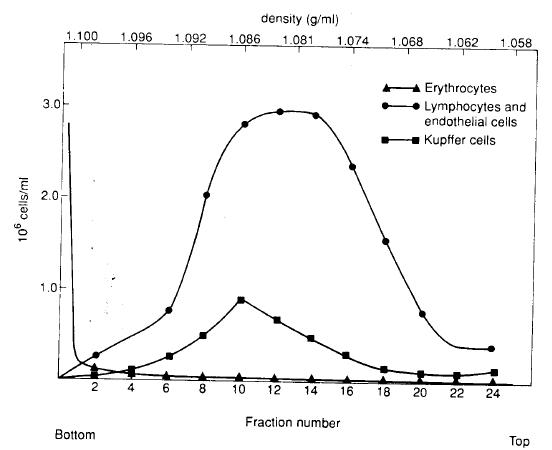
e:结果可以绘成下图从图可以看出:
l Kupffer 细胞在第10 管中占20%,只占总的Kupffer 细胞的一小部分。在第12~14
管中内皮细胞占50%。
l 从结果分析,用这种等密度离心法还不能完全纯化Kupffer 及endothelial 细胞,而
只能用于一般实验需要。