内皮PDGF-CC参与调控米色脂肪的血管生成相关的产热机制
研究背景
脂肪微环境主要是由血管内皮细胞和脂肪细胞组成,它们通过产生各种各样的可溶性因子或细胞表皮因子来进行密切交流。脂肪组织又主要分为白色脂肪组织(WAT)和棕色脂肪组织(BAT),尤其棕色脂肪组织是高度血管化的,这些脂肪血管具有多种重要功能。脂肪组织可以通过产生各种血管生成因子、细胞因子和脂肪因子来调节血管生成、血管存活、血管重塑和血液灌注等。大量证据表明VEGF通过与VEGFR2结合,诱导血管生成,血管渗透和其他血管功能。PDGF-CC通过与PDGFR-α二聚体或PDGFR-α/PDDGFR-β异源二聚体结合诱导动物模型体内的血管生成和血管平衡。
最新研究表明,寒冷刺激诱导的交感神经兴奋显著增加皮下白色脂肪组织褐化过程中的血管生成,血管内皮生长因子是褐化过程中血管生成的重要调节因子。类似于寒冷刺激,由肾上腺素激动剂β3引起的肾上腺素兴奋也能产生类似的褐化现象。PDGFR-α阳性细胞具有独特的细胞形态,并可以作为潜在的脂肪祖细胞在体内外分化为白色或棕色脂肪细胞,这表明PDGFR-α具有重要功能。然而,目前对激活PDGFR-α信号通路能够调控脂肪细胞分化的具体方式,特别是对PDGF-PDGFR-α信号通路对脂肪血管的功能调控作用尚不清楚。
本文证明了内皮PDGF-CC参与调控米色脂肪的产热机制,且该产热机制与米色脂肪的血管生成相关。该成果发表在Nature Communications上,研究中所用的Affymetrix Mouse Gene 2.0 ST Array由上海伯豪生物技术有限公司提供。
研究思路

研究结果
1、肾上腺素激动剂β3(CL)处理后,小鼠VEGF和UCP1表达上调,WAT出现血管生成增加和褐化现象。

2、Ucp1-/-小鼠对CL处理引起的WAT的血管生成表型和褐化不敏感。

3、阻断或敲除VEGFR2,小鼠WAT的血管生成和褐化显著地受到了抑制,且UCP1表达下调。

4、VEGF功能获得后小鼠WAT出现可诱导变米色,整体产热显著性提高。

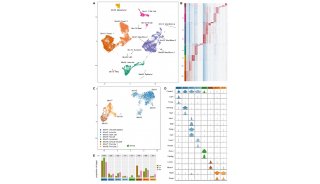
5、芯片实验(CL处理及对照样本)筛选到VEGF 下游基因Pdgf-c。
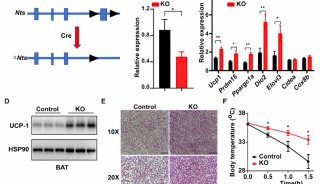
敲除Pdgf-c后WAT褐化现象被抑制,血管生成未受影响。

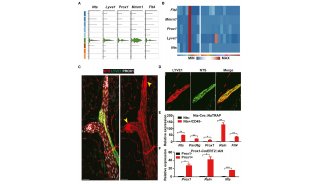
6、PDGF-CC功能获得后UCP1表达上调、能量消耗增加,说明PDGF-CC能够提高高脂饮食小鼠的胰岛素敏感性。进一步发现PDGF-CC能够诱导人和小鼠的PDGFR-α+细胞分化为成熟脂肪细胞(这也与前人研究结果一致),这个过程上调了UCP1表达,说明PDGFR-α参与了褐化过程。在正常人皮下脂肪组织分离的PDGFR-α+细胞中也得到同样结果。

7、阻断PDGFR后减弱了由CL引起的WAT褐化和产热作用,同时证明PDGFR处于VEGF-VEGFR信号下游,通过与PDGF-CC结合诱导褐化现象。

小结
经过一系列研究证明,CL处理后小鼠主要通过VEGF-VEGFR信号通路将信号传递到PDGF-CC,通过与PDGFRs结合,诱导WAT血管生成和褐化,此过程中,上调了UCP1表达,WAT产热增强,同时提高小鼠葡萄糖耐受性和胰岛素敏感度。进一步研究发现,PDGF-CC可诱导已分化的小鼠和人白色脂肪祖细胞获得米色表型。该研究结果对治疗肥胖和代谢相关疾病具有指导意义。

原文出处:Seki T, Hosaka K, Lim S, Fischer C, Honek J, Yang Y, Andersson P, Nakamura M, Näslund E, Ylä-Herttuala S, Sun M, Iwamoto H, Li X, Liu Y, Samani NJ, Cao Y. Endothelial PDGF-CC regulates angiogenesisdependent thermogenesis in beige fat. Nat Commun.2016.