NEJM重磅:国产新冠药物VV116三期临床数据发布
新冠病毒(SARS-CoV-2)导致的COVID-19大流行仍在全球范围内迅速蔓延,而SARS-CoV-2已进化成传播力和免疫逃逸能力更强的突变株Omicron,广泛和及时分发有效的抗病毒药物是应对和抑制大流行的重要措施。
2021年12月,美国FDA批准了辉瑞公司开发的Paxlovid,用于治疗轻中度COVID-19,Paxlovid通过靶向新冠病毒的3CL蛋白酶(3CLpro)来发挥抗病毒作用。但目前Paxlovid的供应量不足,低于全球需求量。
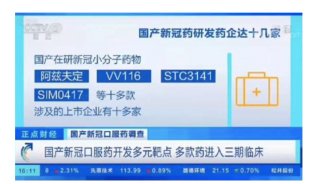
VV116是中国科学院上海药物研究所与中国科学院武汉病毒研究所、中国科学院新疆理化技术研究所等单位共同研发的一款新型口服核苷类抗新冠病毒小分子药物。在动物实验中具有口服生物利用度和抗SARS-CoV-2有效活性,在早期临床试验中具有令人满意的安全性。但VV116在临床恢复、症状缓解和预防疾病进展方面的疗效仍然未知,特别是与Paxlovid相比的效果。此外,VV116的安全性还没有得到充分评估。
2022年12月28日,《新英格兰医学杂志》(NEJM)发表了一篇题为:VV116 versus Nirmatrelvir–Ritonavir for Oral Treatment of Covid-19 的研究论文。
这项3期随机对照临床试验头对头比较了国产新冠药物VV116与辉瑞新冠药物Paxlovid的效果,结果显示,对于有高危因素的轻中度COVID-19成人患者,在至持续临床康复时间方面,VV116非劣于Paxlovid(4天vs5天;风险比为1.17),且不良事件更少。
这项临床试验由上海瑞金医院赵任教授、上海仁济医院皋源教授和上海瑞金医院宁光院士牵头,在7家上海医院开展。这也是Omicron流行期间首个针对COVID-19患者开展的国产口服抗病毒药物头对头3期临床试验。VV116是由中国科学院上海药物研究所与武汉病毒研究所、新疆理化技术研究所等单位共同研发的一种靶向新冠病毒RNA依赖的RNA聚合酶(RdRp)的小分子抑制剂。
包括我国在内的许多国家已经批准Paxlovid用于治疗COVID-19的紧急使用授权。然而,其供应无法满足全球需求。VV116是一款国产口服抗病毒药物,具有抗SARS-CoV-2的有效活性。
上海瑞金医院赵任教授、上海仁济医院皋源教授和上海瑞金医院宁光院士牵头进行了这项在Omicron流行期间的非劣效性、观察者设盲的3期随机试验。有症状的轻度至中度且进展风险高的COVID-19患者,被分配接受接受VV116或Paxlovid的为期5天的疗程。VV116的口服剂量为第1天每12小时服用600毫克,第2-5天每12小时服用300毫克。Paxlovid的口服剂量为5天内每12小时服用300毫克Nirmatrelvir+100毫克Ritonavir。
主要终点为截至第28天时,至持续临床康复的时间。持续临床康复被定义为所有与COVID-19相关的目标症状缓解到每个症状之和的总分为0或1分且持续两天(分数范围为0-3分,分数越高越严重)。风险比的双侧95%置信区间的下限大于0.8则被认为是非劣效性的,风险比>1表明VV116的至持续临床康复时间比Paxlovid短。
在这项临床试验中,共771名新冠患者参与(其中23.4%的参与者未接种新冠疫苗;92.1%的参与者属于轻型,参与者年龄在18-94岁之间,平均年龄为53岁,60岁及以上的比例为37.7%),其中384人接受VV116治疗,387人接受Paxlovid治疗。初步分析中,就至持续临床康复时间而言,VV116与Paxlovid的非劣效性被证实(风险比为1.17,95%置信区间为1.01-1.35),并在最终分析中保持不变(中位数,VV116为4天,Paxlovid为5天;风险比为1.17,95%置信区间为1.02-1.36)。
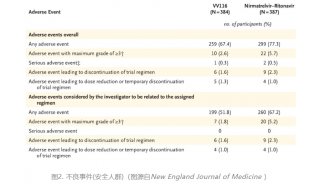
在最终分析中,VV116治疗组与Paxlovid治疗组在至症状持续缓解的时间(连续两天11项COVID-19相关目标症状为0分)和至SARS-CoV-2检测首次呈阴性的时间没有显著差异。截至第28天,两组均无参与者死亡或发展为重症。此外,VV116治疗组的不良事件发生率低于Paxlovid治疗组,前者为67.4%,后者为77.3%。
总的来说,这项头对头比较的3期临床实验结果显示,在高危因素的轻中度COVID-19成年患者中,VV116在至持续临床康复的时间方面不劣于Paxlovid,且安全性问题较少。
-
焦点事件

-
焦点事件

-
焦点事件
-
焦点事件
-
焦点事件

-
焦点事件

-
科技前沿

-
焦点事件

-
焦点事件
-
焦点事件