遗传发育所揭示植物免疫受体调控G蛋白激活机制
异源三聚体G蛋白广泛存在于真核细胞中,对细胞生命活动具有重要调控作用。在动物细胞中,G蛋白α亚基与G蛋白偶联受体(G protein-coupled receptor,GPCR)结合,GPCR感受胞外信号后,发挥鸟苷酸交换因子作用,促使Gα亚基结合的GDP被GTP替换,从而导致G蛋白激活,Gα亚基与Gβγ二聚体发生解离,激活后的G蛋白通过作用于下游靶标实现信号的传递和放大。一类具有GTP水解酶加速活性(GTPase accelerating protein,GAP)的RGS蛋白通过增强Gα的水解酶活性,使GTP快速被水解为GDP,G蛋白重新回到静息状态。与动物细胞不同,植物细胞中并不存在GPCR蛋白,且植物Gα蛋白具有主动结合GTP的自激活能力,因此植物细胞如何调控G蛋白激活一直是植物科学研究领域的一个重大问题。
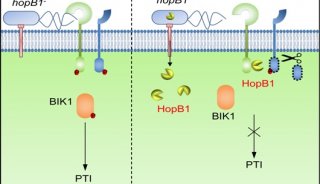
拟南芥免疫受体FLS2能够通过识别细菌鞭毛蛋白来感知病原细菌的入侵,并通过免疫受体复合物的核心激酶BIK1来激活下游免疫反应。中国科学院遗传与发育生物学研究所周俭民研究组的前期研究发现,G蛋白在FLS2介导的免疫反应中发挥重要的调控作用。由Gα蛋白(XLG2和XLG3)、Gβ蛋白(AGB1)和Gγ蛋白(AGG1和AGG2)组成的异源三聚体直接与FLS2偶联。但免疫受体FLS2如何调控G蛋白激活的分子机理并不清楚。
在最新的研究中,遗传发育所周俭民研究组揭示了拟南芥免疫受体FLS2调控植物G蛋白激活的分子机理。在静息状态下,拟南芥唯一的RGS蛋白RGS1同Gα蛋白以及免疫受体FLS2结合在一起,通过RGS1的GAP活性使与Gα蛋白结合的GTP被水解为GDP,从而使G蛋白维持在静息状态。在FLS2感知鞭毛蛋白后,BIK1磷酸化RGS1蛋白Ser431和Ser428,从而导致RGS1与Gα亚基和FLS2的解离,解除RGS1对Gα的抑制作用,Gα因而得以自动结合GTP而激活,促进免疫反应。其中,XLG2在叶肉细胞中调控免疫反应,而GPA1通过调控气孔关闭来阻止病原微生物的入侵。该研究揭示的不同于动物G蛋白新型激活方式即植物细胞G蛋白的激活是通过受体诱导RGS1的磷酸化,从而解除对Gα的抑制作用实现的。
相关研究成果发表在Cell Research上,博士后梁祥修、博士研究生马苗苗为论文共同第一作者。该研究得到了国家自然科学基金委、科技部、中科院战略性先导科技专项和植物基因组学国家重点实验室的资助。
-
科技前沿

-
科技前沿

-
项目成果
-
科技前沿
-
精英视角