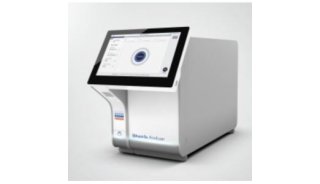
Qiagen公司QiaStat-Dx呼吸道SARS-CoV-2诊断平台获FDA紧急授权
分析测试百科网讯 近日,Qiagen获得了美国食品药品监督管理局(FDA)关于QiaStat-Dx呼吸道SARS-CoV-2诊断平台的紧急使用授权,可用于诊断感染COVID-19冠状病毒的患者。

该诊断平台可以从有症状患者的鼻咽拭子中检测出并区分出SARS-CoV-2和其他20种已知会引起严重呼吸系统疾病的病毒和细菌病原体,并将成为美国首款“综合症状”诊断产品。
具体而言,QiaStat-Dx诊断平台可检测和区分SARS-CoV-2和腺病毒中的核酸以及其他病毒,包括:其他四种冠状病毒;人间质肺病毒A + B;甲型,甲型H1,甲型H3,甲型H1N1 / pdm09和B型流感;副流感病毒1-4;鼻病毒/肠病毒,呼吸道合胞病毒A + B,百日咳博德特氏菌,肺炎衣原体和肺炎支原体。
Qiagen全自动多重实时PCR测试可在从样品到答案的QiaStat-Dx诊断平台上运行,约一个小时内能得到来自患者鼻咽拭子的检测结果。
新产品是对Qiagen现有QiaStat-Dx诊断平台的更新,该产品先前已获得FDA批准和CE标记。更新后的诊断平台包括两个针对SARS-CoV-2的分子靶标:中国疾病预防控制中心推荐的ORF1b基因和美国疾病预防控制中心推荐的N基因。 该公司从美国卫生与公共服务部生物医学高级研究与开发局获得了59.8万美元的资金,以帮助开发该诊断平台。
根据FDA修订的紧急冠状病毒测试政策,Qiagen上周开始将QiaStat-Dx SARS-CoV-2试剂盒运往美国。 该公司表示,已在美国放置了200多个QiaStat-Dx仪器,在全球放置了1100多个。在本月早些时候,Qiagen诊断平台也获得了CE标志。
Qiagen首席执行官Thierry Bernard在一份声明中说:“QiaStat-Dx综合诊断平台为临床医生添加了重要的工具。我为我们的Qiagen团队不懈努力以实现24/7全天候测试盒和测试组件的生产感到自豪。除了QiaStat-Dx,我们还提供QiaAmp和EZ1品牌的RNA提取试剂盒等用于抗击全球这场公共卫生危机的众多产品。”
同样在周一,美国公司NeuMoDx接受了FDA EUA的COVID-19测定,该测定在该公司的全自动、高通量NeuMoDx 288和NeuMoDx 96分子测试系统上运行。2018年,Qiagen达成协议收购NeuMoDx,而现在Qiagen正在以115亿美元的价格被赛默飞收购。