31项与免疫学有关的分子生物学实验技术(一)
现代分子生物学和免疫学的进展加深了我们对许多疾病的了解,并且导至了免疫新策略的产生,免疫学检测方法可分为体液免疫和细胞免疫测定。本文盘点了与免疫学有关的分子生物学实验技术汇总。
一、GST pull-down实验
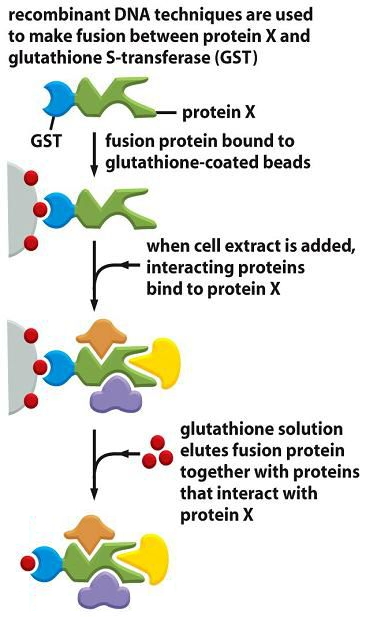
GST是指谷胱甘肽巯基转移酶,GST pull-down实验是一个行之有效的验证酵母双杂交系统的体外试验技术,近年来越来越受到广大学者的青睐。
GST pull-down实验是将靶蛋白-GST融合蛋白亲和固化在谷胱甘肽亲和树脂上,作为与目的蛋白亲和的支撑物,充当一种“诱饵蛋白”;目的蛋白溶液过柱,可从中捕获与之相互作用的“捕获蛋白”(目的蛋白),洗脱结合物后通过SDS-PAGE电泳分析,从而证实两种蛋白间的相互作用或筛选相应的目的蛋白;“诱饵蛋白”和“捕获蛋白”均可通过细胞裂解物、纯化的蛋白、表达系统以及体外转录翻译系统等方法获得。
二、足迹法(Footprinting)
足迹法全称为DNA footprinting,又称DNA足迹法或DNA足纹技术,能鉴定启动子区域特殊位点的功能。
Footprinting是一种用来测定DNA-蛋白质专一性结合的方法,用于检测目的DNA序列与特定蛋白质的结合,也可展示蛋白质因子同特定DNA片段之间的结合。当DNA和蛋白质结合后,DNA与蛋白的结合区域不能被DNase(脱氧核糖核酸酶)分解,在对目的DNA序列进行检测时便出现了一段无DNA序列的空白区(蛋白质结合区),从而了解与蛋白质结合部位的核苷酸数目及其核苷酸序列。
三、染色质免疫共沉淀技术(Chromatin Immunoprecipitation,ChIP)
ChIP是研究体内蛋白质与DNA相互作用的有力工具,利用该技术不仅可以检测体内反式因子与DNA的动态作用,还可以用来研究组蛋白的各种共价修饰以及转录因子与基因表达的关系。
在生理状态下,把细胞内的DNA与蛋白质交联在一起,通过超声或酶处理将染色质切为小片段后,利用抗原抗体的特异性识别反应,将与目的蛋白相结合的DNA片段沉淀下来。染色质免疫沉淀技术一般包括细胞固定,染色质断裂,染色质免疫沉淀,交联反应的逆转,DNA的纯化及鉴定。
四、基因芯片技术
基因芯片又称DNA芯片、生物芯片技术,基因芯片指将大量探针分子固定于支持物上后与标记的样品分子进行杂交,通过检测每个探针分子的杂交信号强度进而获取样品分子的数量和序列信息。
通俗地说,就是通过微加工技术,将数以万计、乃至百万计的特定序列的DNA片段(基因探针),有规律地排列固定于50px2 的硅片、玻片等支持物上,构成的一个二维DNA探针阵列,被称为基因芯片。基因芯片主要用于基因检测工作 。
基因芯片的测序原理是杂交测序方法,即通过与一组已知序列的核酸探针杂交进行核酸序列测定的方法,在一块基片表面固定了序列已知的八核苷酸的探针。当溶液中带有荧光标记的核酸序列TATGCAATCTAG,与基因芯片上对应位置的核酸探针产生互补匹配时,通过确定荧光强度最强的探针位置,获得一组序列完全互补的探针序列。据此可重组出靶核酸的序列。
五、高效液相色谱(HPLC)法
HPLC是在经典色谱法的基础上,引用了气相色谱的理论,在技术上,流动相改为高压输送;色谱柱是以特殊的方法用小粒径的填料填充而成,从而使柱效大大高于经典液相色谱(每米塔板数可达几万或几十万);同时柱后连有高灵敏度的检测器,可对流出物进行连续检测。
高压泵将贮液罐的流动相经进样器送入色谱柱中,然后从检测器的出口流出,这时整个系统就被流动相充满。当欲分离样品从进样器进入时,流经进样器的流动相将其带入色谱柱中进行分离,分离后不同组分依先后顺序进入检测器,记录仪将进入检测器的信号记录下来,得到液相色谱图。
六、酵母双杂交(Y2H)
酵母双杂交由Fields在1989年基于对真核细胞转录因子特别是酵母转录因子GAL4性质的研究。 GAL4包括两个彼此分离的但功能必需的结构域。
Fields建立了一个双杂交系统,能够识别位于GAL4效应基因的上游激活序列(UAS)、位于N端1-147位氨基酸残基区段的DNA结合域(DNA-BD)与X蛋白融合,能够启动UAS下游的基因进行转录、位于C端768-881 位氨基酸残基区段的转录激活域(AD)与Y蛋白融合,如果X、Y之间形成蛋白-蛋白复合物,使GAL4两个结构域重新构成,则会启动特异基因序列的转录。
DNA-BD和AD单独分别作用并不能激活转录反应,但是当二者在空间上充分接近时,则呈现完整的GAL4转录因子活性并可激活UAS下游启动子,使启动子下游基因得到转录。
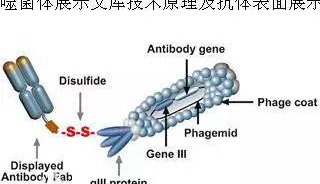
七、噬菌体展示技术
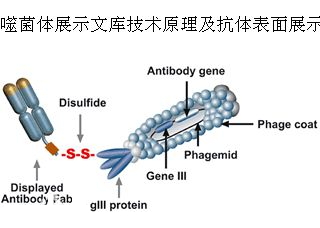
噬菌体展示技术是将外源蛋白或多肽的DNA序列插入到噬菌体外壳蛋白结构基因的适当位置,使外源基因随外壳蛋白的表达而表达,同时,外源蛋白随噬菌体的重新组装而展示到噬菌体表面的生物技术。
肽库与固相上的靶蛋白分子经过一定时间孵育后,洗去未结合的游离噬菌体,然后以竞争受体或酸洗脱下与靶分子结合吸附的噬菌体,洗脱的噬菌体感染宿主细胞后经繁殖扩增,进行下一轮洗脱,经过3轮~5轮的“吸附-洗脱-扩增”后,与靶分子特异结合的噬菌体得到高度富集,所得的噬菌体制剂可用来做进一步富集有期望结合特性的目标噬菌体。
八、RNA提取(Trizol法)
Trizol试剂中的主要成分为异硫氰酸胍和苯酚,其中异硫氰酸胍可裂解细胞,促使核蛋白体的解离,使RNA与蛋白质分离,并将RNA释放到溶液中。当加入氯仿时,它可抽提酸性的苯酚,而酸性苯酚可促使RNA进入水相,离心后可形成水相层和有机层,这样RNA与仍留在有机相中的蛋白质和DNA分离开。水相层(无色)主要为RNA,有机层(黄色)主要为DNA和蛋白质。
九、RT-PCR
RT-PCR是将RNA的反转录(RT)和cDNA的聚合酶链式扩增(PCR)相结合的技术。首先经反转录酶的作用从RNA合成 cDNA,再以cDNA为模板,扩增合成目的片段。RT-PCR可以一步法或两步法的形式进行。在两步法RT-PCR中,每一步都在最佳条件下进行。
实验步骤主要包括:1)RNA的提取;2)反转录合成cDNA;3)PCR扩增;4)产物的电泳和结果的测定。
十、实时荧光定量PCR(Q—PCR)(Real-time Quantitative PCR )
利用荧光信号的变化实时检测PCR扩增反应中每一个循环扩增产物量的变化,通过Ct值(扩增产物荧光信号到达阈值时所经过的扩增循环次数)和标准曲线的关系对起始模板进行定量分析。
十一、BCA法测蛋白质浓度
二价铜离子在碱性的条件下,可以被蛋白质还原成一价铜离子,一价铜离子和独特的BCA溶液相互作用产生敏感的颜色反应。两分子的BCA螯合一个铜离子,形成紫色的反应复合物。该水溶性的复合物在562nm处显示强烈的吸光性,吸光度和蛋白浓度在广泛范围内有良好的线性关系,因此根据吸光值可以推算出蛋白浓度。