31项与免疫学有关的分子生物学实验技术(二)
十二、大肠杆菌感受态细胞(E.coli DH5α)制备
E.coli DH5α制备主要操作步骤:
1)挑取受体菌(DH5或DH10B)的单菌落于LB培养基中37℃摇床培养过夜(约16小时);2)取1ml过夜培养物转接于100ml LB培养基中,在37℃摇床上剧烈振荡培养约2.5-3小时(250-300rpm);3)将0.1M CaCl2溶液置于冰上预冷;以下步骤需在超净工作台和冰上操作;4)吸取1.5ml培养好的菌液至1.5ml离心管中,在冰上冷却10分钟;5)4℃下3000 g冷冻离心5分钟;6)弃去上清,加入100μL预冷0.1M CaCl2溶液,用移液枪轻轻上下吸动打匀,使细胞重新悬浮,在冰放置20分钟;7)4℃下3000g冷冻离心5分钟;8)弃去上清,加入100μL预冷0.1M CaCl2溶液,用移液枪轻轻上下吸动打匀,使细胞重新悬浮;9 )细胞悬浮液可立即用于转化实验或添加冷冻保护剂(15%-20%甘油)后超低温(-70℃)冷冻贮存备用。
十三、碱变性提取质粒DNA
碱变性提取质粒DNA是基于染色体DNA与质粒DNA的变性与复性的差异而达到分离目的。在pH高达12.6的碱性条件下,染色体DNA的氢键断裂,双螺旋结构解开而变性。
质粒DNA的大部分氢键也断裂,但超螺旋共价闭合环状的两条互补链不会完全分离:当以pH4.8的NaAc高盐缓冲液去调节其pH至中性时,变性的质粒DNA又恢复原来的构型,保存在溶液中,而染色体DNA不能复性而形成缠连的网状结构,通过离心,染色体DNA与不稳定的大分子RNA、蛋白质-SDS复合物等一起沉淀下来而被除去。
十四、目的基因的连接、转化及克隆筛选
总过程:分-——PCR分离目的基因;切-——限制性内切酶切割;接-——目的基因与载体相连;转-——转入宿主细胞;筛-——筛选阳性重组体。
1)分-——PCR分离目的基因:PCR克隆、同源克隆、文库筛选;2)切-——限制性内切酶切割:粘性末端、平末端;3)接-——目的基因与载体相连;4)转-——转入宿主细胞;5)筛-——筛选阳性重组体。
十五、RNA干扰(RNAi)
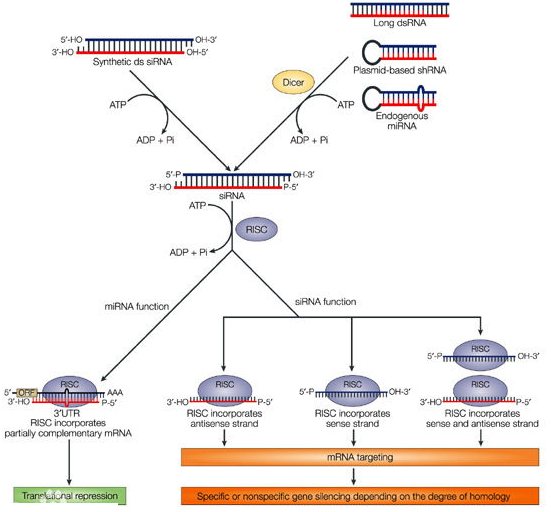
RNA干扰是将一些小的双链RNA通过促使特定基因的mRNA降解来高效、特异的阻断体内特定基因表达,诱使细胞表现出特定基因缺失的表型。
十六、cDNA 末端快速扩增(rapid amplification of cDNA ends,RACE)技术
RACE技术是一种基于mRNA反转录和 PCR技术建立起来的、以部分的已知区域序列为起点,扩增基因转录本的未知区域,从而获得mRNA(cDNA)完整序列的方法。
简单的说,即一种从低丰度转录本中快速增长cDNA5’和cDNA3’末端,进而获得获得全长cDNA简单而有效的方法,目前已逐渐取代了经典的cDNA文库筛选技术,成为克隆全长cDNA序列的常用手段。
十七、基因文库和cDNA文库的构建
基因文库构建需要首先得到mRNA,再反转录得cDNA,经克隆后形成文库。将载体导入到受体细菌或细胞中,使得细胞包含了一个基因组DNA片段与载体重组DNA分子,经过繁殖扩增,许多细胞一起包含了该生物全部基因组序列,形成的集合体叫做基因文库。基因文库与基因组文库(又名基因库)的区别在于基因文库在mRNA拼接过程中已经除去了内含子等成分,便于DNA重组时直接使用。
十八、mRNA差异显示技术(DD-PCR)
mRNA差异显示技术是将mRNA逆转录技术和PCR技术相结合的一种RNA指纹图谱技术。mRNA DDPCR 技术是对组织特异性表达基因进行分离的一种快速而行之有效的方法:从基因背景相同的2个或几个被比较的细胞系或组织中提取总RNA,逆转录成cDNA ,用不同引物对,进行PCR 扩增,扩增时加入同位素标记的核苷酸。利用测序胶电泳技术分离PCR 产物,经放射自显影即可找到差异表达的基因。
十九、抑制差减杂交
抑制差减杂交技术原理抑制差减杂交技术(SSH)是由Diatchenko等建立的以抑制性PCR和DNA差减杂交方法相结合的方法。其依据的主要技术有两点:(1)消减杂交;(2)抑制PCR。经抑制差减杂交后的cDNA群体不仅富集了差异表达基因(目的基因),而且目的基因间丰度的差异经过均等化作用已基本消除,使消减后的cDNA群体为丰度一致的目的基因群体。
二十、蛋白质芯片
蛋白质芯片是一种高通量的蛋白功能分析技术,可用于蛋白质表达谱分析,研究蛋白质与蛋白质的相互作用,甚至DNA-蛋白质、RNA-蛋白质的相互作用,筛选药物作用的蛋白靶点等。
蛋白质芯片是对固相载体进行特殊的化学处理,再将已知的蛋白分子产物固定其上(如酶、抗原、抗体、受体、配体、细胞因子等),根据这些生物分子的特性,捕获能与之特异性结合的待测蛋白(存在于血清、血浆、淋巴、间质液、尿液、渗出液、细胞溶解液、分泌液等),经洗涤、纯化,再进行确认和生化分析。
二十一、Northern blot
Northern blot是一种通过检测RNA的表达水平来检测基因表达的方法,通过northern blot的方法可以检测到细胞在生长发育特定阶段或者胁迫或病理环境下特定基因表达情况。该方法首先通过电泳的方法将不同的RNA分子依据其分子量大小加以区分,然后通过与特定基因互补配对的探针杂交来检测目的片段。
二十二、Southern blot
Southern blot即Southern印迹杂交,是1975年由英国人Southern创建,是研究DNA图谱的基本技术,是进行基因组DNA特定序列定位的通用方法。该方法包括两个主要过程:1)将待测定核酸分子通过一定的方法转移并结合到一定的固相支持物(硝酸纤维素膜或尼龙膜)上,即印迹(blotting);2)固定于膜上的核酸与同位素标记的探针在一定的温度和离子强度下退火,即分子杂交过程。
二十三、荧光共振能量转移
荧光共振能量转移是指在两个不同的荧光基团中,如果一个荧光基团(供体 Donor)的发射光谱与另一个基 团(受体 Acceptor)的吸收光谱有一定的重叠,当这两个荧光基团间的距离合适时(一般小于100Å),就可观察到荧光能量由供体向受体转移的现象,即以前一种基团的激发波长激发时,可观察到后一个基团发射的荧光。
简单地说,就是在供体基团的激发状态下由一对偶极子介导的能量从供体向受体转移的过程,此过程没有光子的参与,所以是非辐射的,供体分子被激发后,当受体分子与供体分子相距一定距离,且供体和受体的基态及第一电子激发态两者的振动能级间的能量差相互适应时,处于激发态的供体将把一部分或全部能量转移给受体,使受体被激发,在整个能量转移过程中,不涉及光子的发射和重新吸收。如果受体荧光量子产率为零,则发生能量转移荧光熄灭;如果受体也是一种荧光发射体,则呈现出受体的荧光,并造成次级荧光光谱的红移。
二十四、双分子荧光技术(BiFC)
BiFC分析技术是一种直观、快速地判断目标蛋白在活细胞中的定位和相互作用的新技术。该技术巧妙地将荧光蛋白分子的两个互补片段分别与目标蛋白融合表达,如果荧光蛋白活性恢复则表明两目标蛋白发生了相互作用。
BiFC分析利用绿色荧光蛋白(GFP)及其突变体的特性作为报告基因,将荧光蛋白分割成两个不具有荧光活性的分子片段,再分别与目标蛋白连接。如果两个目标蛋白因为有相互作用而靠近,就使得荧光蛋白的两个分子片段在空间上相互靠近,重新形成活性的荧光基团而发出荧光。
在荧光显微镜下,就能直接观察到两目标蛋白是否具有相互作用,并且在最接近活细胞生理状态的条件下观察到其相互作用发生的时间、位置、强弱、所形成蛋白质复合体的稳定性,以及细胞信号分子对其相互作用的影响等,这些信息对研究蛋白质相互作用有一定意义。
二十五、双向凝胶电泳(2-DE)
双向凝胶电泳的原理是第一向基于蛋白质的等电点不同用等电聚焦分离,第二向则按分子量的不同用SDS-PAGE分离,把复杂蛋白混合物中的蛋白质在二维平面上分开。
电泳后根据蛋白质的上样量对胶进行考马斯亮兰染色、银染或荧光染色,然后用相关软件对电泳图象进行分析。
二十六、mRNA的分离与纯化
mRNA的分离方法较多,以寡聚(dT)-纤维素柱层析法最为有效,已成为常规方法。此法利用mRNA 3’末端含有Poly(A+)的特点,在RNA流经寡聚(dT)纤维素柱时,在高盐缓冲液的作用下,mRNA被特异地结合在柱上,当逐渐降低盐的浓度时或在低盐溶液和蒸馏水的情况下,mRNA被洗脱,经过两次寡聚(dT)纤维柱后,即可得到较高纯度的mRNA。
二十七、His-tag纯化蛋白
His•Tag序列(6、8或10个连续的组氨酸残基)与固定在基于NTA(氮川三乙酸镍) -和IDA- 的His•Bind树脂上的二价阳离子Ni2+结合。洗去未结合蛋白后,用咪唑或稍低的pH洗脱并回收目标蛋白。该通用系统使得可在温和、非变性条件,或存在6M胍或尿素条件下纯化蛋白。
二十八、RNA酶保护试验方法(RNase Protection Assay,RPA)
RNA酶保护法是近十年发展起来的一种全新的mRNA定量分析方法。
该法将标记的特异RNA探针(32P或生物素)与待测的RNA样品液相杂交,标记的特异RNA探针按碱基互补的原则与目的基因特异性结合,形成双链RNA;未结合的单链RNA经RNA酶A或RNA酶T1消化形成寡核糖核酸,而待测目的基因与特异RNA探针结合后形成双链RNA,免受RNA酶的消化,故该方法命名为RNA酶保护实验。
二十九、用于流式细胞仪的IL-17家族抗体
IL-17家族配体是诱导局部细胞因子产生的促炎症细胞因子,并参与了免疫功能的调节,主要是变态反应。
IL-17家族抗体包括6个成员:IL-17、IL-17B、IL-17C、IL-17D、IL-17E(也就是IL-25)和IL-17F是结构相关的蛋白,在C端附近有着保守的半胱氨酸结折叠,N端的序列差异相当大;IL-17家族成员激活三个受体——IL-17 R、IL-17B R和IL-17 RC;两个与IL-17 R同源的孤儿受体分别命名为IL-17 RD和IL-17 RE,它们的功能配体目前还不清楚。
三十、各种分子标记技术的比较
1)限制性片段长度多态性(RFLP)
RFLP是检测DNA 在限制性内切酶酶切后形成的特定DNA 片段的大小,反映DNA 分子上不同酶切位点的分布情况,因此DNA 序列上的微小变化,甚至1 个核苷酸的变化,也能引起限制性内切酶切点的丢失或产生, 导至酶切片段长度的变化。
RFLP可以作为遗传标记,开创了直接应用DNA 多态性的新阶段,是最早应用的分子标记技术。
2)随机扩增多态DNA (RAPD)
RAPD技术建立于PCR 基础之上的分子标记技术,基本原理是利用一个随机引物(8~10 个碱基)通过PCR 反应非定点地扩增DNA 片段,然后用凝胶电泳分离扩增片段来进行DNA 多态性研究。对任一特定引物而言,它在基因组DNA 序列上有其特定的结合位点,一旦基因组在这些区域发生DNA 片段插入、缺失或碱基突变,就可能导至这些特定结合位点的分布发生变化,从而导至扩增产物的数量和大小发生改变,表现出多态性。
由于RAPD独特的检测DNA 多态性的方式使得RAPD 技术很快渗透于基因研究的各个领域。
3)扩增片段长度多态技术(AFLP)
AFLP又名限制片段选择扩增技术,是1993 年由荷兰KEYGENE 公司的Zabean 和Vos 等发明。AFLP 是近年来迅速发展起来的一种分子标记技术,它将基因组DNA 用成对的限制性内切酶双酶切后产生的片段用接头(与酶切位点互补) 连接起来,并通过5′端与接头互补的半特异性引物扩增得到大量DNA 片段,从而形成指纹图谱的分子标记技术。
AFLP 指纹呈孟德尔式共显性和显隐性遗传。
4)卫星DNA(SSR)
SSR 是一类由几个碱基组成的基序串联重复而成的DNA 序列,其中最常见的是双核苷酸重复,即(CA)n和(TG)n ,每个微卫星DNA 的核心序列结构相同,重复单位数目10~60 个,其高度多态性主要来源于串联数目的不同。不同遗传材料重复次数不同,导至了SSR 长度的高度变异性,这一变异性正是SSR 标记产生的基础。
4)单核苷酸多态性(SNP)
SNP被称为第3 代DNA 分子标记,是指同一位点的不同等位基因之间个别核苷酸的差异,这种差异包括单个碱基的缺失或插入 ,更常见的是单个核苷酸的替换,且常发生在嘌呤碱基(A 与G)和嘧啶碱基(C 与T)之间。
SNP 标记可帮助区分两个个体遗传物质的差异,被认为是应用前景最好的遗传标记。
三十一、 时间分辨荧光免疫分析法(TRFIA)
TRFIA 所使用的荧光标记物是镧系稀土金属,镧系稀土金属离子螯合物荧光很宽的Stokes 位移使其容易通过波长分辨方式进一步区别于背景荧光,提高方法学的稳定性。
由于镧系稀土金属离子螯合物有很长的荧光寿命(微秒级),有别于传统荧光的短荧光寿命,使其能通过时间分辨方式区别于背景荧光(钠秒级),正是由于荧光衰变时间长,可以延缓测量时间,待测样品中短寿命的本底荧光衰变后再测稀土离子的特异荧光,因此可完全消除本底荧光的干扰。
备注:本文统计或不完全,欢迎补充,内容综合自网络和《生物实验室系列——分子免疫学实验指南》一书。