一些IND安全报告不再使用eCTD提交,该怎么理解
报道
日前,FDA发布电子格式提交临床研究用新药安全性报告指南草案,
要求申办者在指南最终版发布24个月后,向FDA不良事件报告系统提交IND的严重和意外可疑不良事件安全报告
。做出这一规定的原因何在?具体涉及到哪些提交?

改变现行提交方式,改进审查、跟踪效率
按照现行要求,FDA要求这些报告都以PDF格式的电子通用技术文件提交。但对这些文件的审查和跟踪效率低下,耗费大量人力。因此,
FDA要求将这些重要的安全信息作为结构化数据元提交给FAERS,有助于提高 FDA 审查和跟踪临床试验期间发生的潜在安全信号的能力
,并为申办方提供符合ICH E2B要求以及向其它监管机构报告的要求报告格式。对相关提交要求的转变,是FDA具体落实《联邦食品、药品和化妆品法案》第745A节规定的电子提交要求工作的一部分。
FDA表示,申办方目前还可以继续通过eCTD提交相关的IND安全报告;但在要求生效之前,申办方可以自愿向FAERS提交报告。但最终版指南一旦生效,FDA将要求IND安全报告的提交符合新指南的规定,取代2019年1月颁布的《按照eCTD规范提交部分人用药品申请和相关提交》行业指南的相关规定。

依据指南规定,
申办方必须通过 FDA 的电子提交网关或安全报告门户 , 向FAERS 提交相关的 IND安全报告
。
通过FAERS提交IND安全报告所涉范围
新公布的指南草案,不适用于严重和意外疑似不良事件之外的IND安全报告
,诸如详细说明来自于其它研究的结果的报告,来自于实验动物或体外检测的结果,或严重疑似不良反应发生率增加的报告。此外,FDA表示,尽管FDA鼓励申办方以电子方式提交,非商业性IND的提交,将豁免第745A节规定的电子提交要求。
除了指南草案之外,作为指南草案的补充,FDA 还发布了单独的技术符合性指南,详细说明应以eCTD格式提交给FDA的个案安全报告 ,以及提交给 FAERS 的 IND 安全报告应采用的格式。
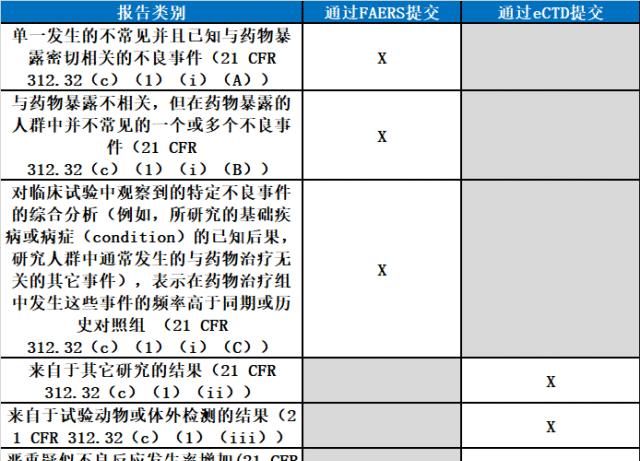
IND安全报告的类别与提交方式
FDA正在就这份指南草案征询医药行业和利益攸关方的建议与意见,征询日期截止于今年年底。
-
焦点事件
-
企业风采

-
企业风采

-
焦点事件
-
焦点事件



















