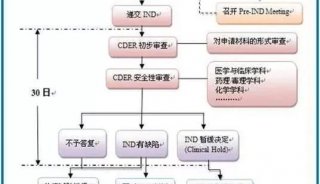
药物申报IND处于新药研发哪个环节?
作者:药渡
链接:https://www.zhihu.com/question/267087191/answer/318158551
来源:知乎
著作权归作者所有。商业转载请联系作者获得授权,非商业转载请注明出处。
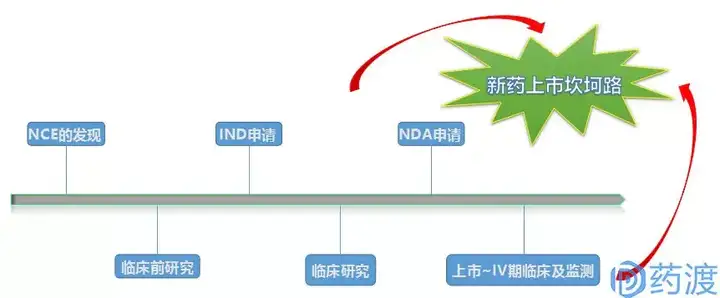
创新药物从结构设计到发现、再到最终的获批上市,经历的是一个充满荆棘的系统的炼狱过程。简要的说,首先是新化学实体NCE的发现,其主要包括先导化合物、候选药物的确定;之后进入到临床前研究阶段,这一过程主要包括药理、毒理、药代、处方前研究等内容;待完成初步临床前评价后,即将进入临床研究之时,开发公司申请人须向相应药审部门进行注册申报,这个节点就是本文要讲的内容~IND申请;待药审部门通过IND申请或者没有反馈意见时,项目便进入到下一阶段,即I、II、III期临床研究;待临床前研究、临床研究全部或部分完成之后,如果达到了预期目的,即可提交新药上市申请NDA,以求获批上市销售;上市后,开发公司仍需对产品进行IV期临床研究和上市后监测,使之更加充分的理解药物的机理、范围、治疗作用、副作用,等等等等....
推荐