核仁小RNA的功能及其在癌症研究中的作用(一)
为什么研究snoRNAs?
引言
核仁小RNA(snoRNAs)是一类中等长度的非编码小RNA,它们的长度在60-300nt不等,能与核仁核糖核蛋白结合形成snoRNPs 复合物[1]。在脊椎动物中编码核仁小RNA的基因主要存在于蛋白编码基因或非蛋白编码基因的内含子区域,并且经过进一步的转录后加工处理形成成熟的核仁小RNA[2]。snoRNAs参与的生物学过程主要有rRNA的加工处理,RNA剪接和翻译过程的调控以及氧化应激反应[3]。近期的研究表明snoRNAs还参与到遗传性疾病[4]、人类的变异[5]、造血[6]、代谢[7, 8]以及癌症[3, 9]的过程中。
snoRNAs的生物合成
snoRNAs主要包含两个家族:C/D
box snoRNAs 与H/ACA box snoRNAs (Fig.1A and
Fig.1B)。大多数snoRNAs主要位于由RNA聚合酶II转录的基因的内含子区域(Fig.1C)[9]。但snoRNAs也可以来源于长链非编码RNA(lncRNA)的内含子区域。例如GAS5
编码9个不同的C/D box
snoRNAs(snoRNDs74-81)[10]。从内含子上脱离后,pre-snoRNAs进一步的被核酸外切酶处理去除两端的多余序列,进而形成成熟的snoRNAs.。snoRNAs内部的信号序列指导snoRNAs与相应蛋白结合形成snoRNP复合物来避免被酶切,进而发挥功能。

Fig1: The structure and biogenesis of snoRNAs. A. The
2′-O-methylated nucleotides located five nucleotides upstream of the D
or D’ box sequences are indicated as red. B. Positions and consensus
sequences of the conserved C, C’ box (UGAUGA), and D, D’ boxes (CUGA).
The uridine residues selected for pseudouridylation are shown as. C.
Biogenesis of snoRNAs :The great majority of mammalian box C/D and H/ACA
snoRNAs are processed from pre-mRNA introns. snoRNAs families are not
independently transcribed but processed from the pre-mRNA introns, in
most cases by exonucleolytic digestion of the debranched lariat. Box C/D
snoRNAs contain four evolutionarily conserved, essential proteins,
fibrillarin (methyltransferase), Nop56, Nop58, and 15.5kDa. Proteins
common to H/ACA snoRNAs include dyskerin (pseudouridine synthase), Gar1,
Nhp2, and Nop10p[9].
snoRNAs的功能
snoRNAs在核糖体RNA加工过程的作用
在核糖体RNA的加工过程中,snoRNAs发挥这两个基本的作用:核糖体RNA的2′ -O –甲基化和假尿嘧啶化[11]。核糖体RNA的2′ -O –甲基化由C/D box snoRNAs来负责。 C/D box snoRNAs 包含有两个短的序列元件,即位于5 " 末端的box C(RUGAUGA R代表A或G)和3" 末端的box D(CUGA)。多数box C/ D snoRNAs基因的5" 和3" 末端都有4 - 5 nt 的反向重复序列,可以形成较为稳定的短茎结构,这一结构在snoRNAs的生物合成和核仁定位过程中起关键作用(Fig. 1A)[12]。大部分C/D box snoRNAs的中部,还具有类似于box C 和box D 的结构,通常分别表现出 1 - 2 nt的差异,被称为box C" 和box D"[13]。核糖体RNA的假尿嘧啶修饰主要是由H/ACA box snoRNAs来完成的。H/ACA box snoRNAs 具有保守的“发夹- 铰链- 发夹- 尾(hairpin-hinge hairpin -tail ) ”的二级结构( Fig.1B)[13] 。box H (ANANNA,N 代表任一核苷酸)位于单链形式的铰链区,ACA 则一般位于3" 末端上游3个核苷酸处。H/ACA box snoRNAs的指导序列位于单个或者两个发夹内部的“假尿嘧啶化泡”(pseudouridylation pocket) 内,它们可以与靶RNA上的被修饰位点两翼序列各形成4 - 8nt 的互补配对。另外还有一种比较特殊的snoRNAs- SCARNAs,只特异存在于Cajal小体中,能够对剪接体RNA进行2′ -O –甲基化和假尿嘧啶化修饰[14]。
snoRNAs作为miRNA前体
越来越多的实验结果表明snoRNAs可以进一步被加工形成更短片段的RNA,并且这些短片段的snoRNAs具有类似miRNA的功能,这就表明snoRNAs可能作为miRNA的前体[15]。ACA45是第一个被报道能够被降解成短片段的snoRNAs,它是通过与Ago蛋白的相互作用被发现的,而Ago作为miRNA RISC复合物的成员,这就表明ACA45的进一步的加工处理是依赖于Dicer酶的。进一步的实验表明,降解产生的20-22nt的短片段RNA的作用机制类似与miRNA-抑制目的基因(CDC2L6)的表达[15]。近期报道发现11个C/D box snoRNAs能够降解形成短片段RNA从而抑制靶基因的表达[16]。
snoRNAs在可变剪切过程中的作用
snoRNAs既能作为miRNA的前体也可以调节RNA的可变性剪切。研究报道HBII-52 C/D box snoRNAs上的18个核苷酸能够与5-羟色胺受体5-HT (2C)的mRNA序列互补配对进而通过影响5-羟色胺受体5-HT (2C)的可变剪切来调控5-羟色胺受体的表达,最终导致Prader-Willi综合征[17]。
snoRNAs在应急反应过程中的作用
核仁是细胞应对应急反应的主要参与者。不同的压力条件能够导致核仁的变化甚至破坏它。据报道,snoRNAs有助于细胞应对应急反应。在缺氧条件下,SNORD14A
和SNORD83B的表达水平得到显著提高[18]。另有报道发现,棕榈酸酯处理能够导致细胞中SNORDs 32A, 33,
和35A的表达水平也显著提高。细胞对棕榈酸酯产生抗性是由于抑制了SNORDs 32A, 33,
和35A的表达,它们介导了由诱导剂引起的细胞死亡[7]。只有在细胞应急反应的早期过程中能够在细胞质中检测到snoRNAs的存在。例如,在代谢压力的早期过程中,相互独立的snoRNAs(SNORD3,
SNORD13和
SNORD118)以及它们各自的靶向mRNA在细胞质中相互依存并且调节它们的翻译。snoRNAs参与调节的细胞过程将会更加复杂。
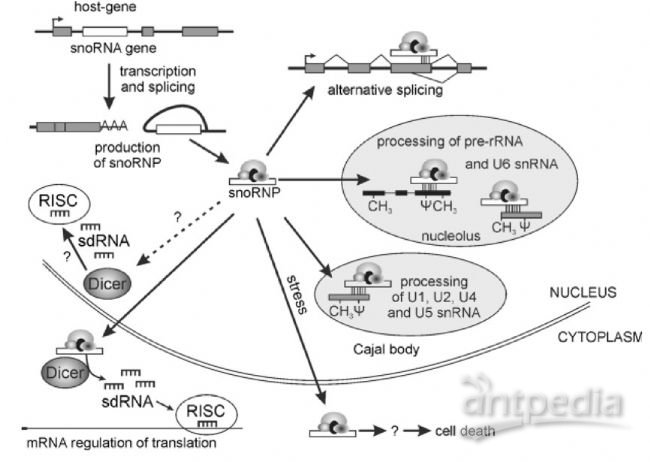
Fig2: snoRNAs参与的细胞过程[19]




















