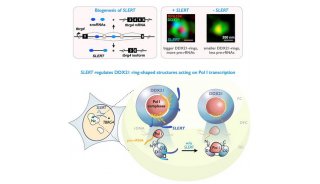
核仁小RNA的功能及其在癌症研究中的作用(二)
snoRNAs在癌症中的作用
snoRNAs参与的癌症的分子病理学
研究snoRNAs在癌症中的作用起始于一项研究:在脑膜瘤中,与正常脑组织相比snoRNAs的表达大幅下调[20]。最近研究发现,在非小细胞肺癌中多种snoRNAs呈现出不同的表达状态[21]。其它的研究证明snoRNAs U50 2bp纯合缺失突变与前列腺癌的发生发展有关[22]并且在乳腺癌中U50具有杂合缺失以及转录下调的特点[23]。另有研究发现snoRNAs以及lncRNA的hostgene-GAS5能够调控细胞的生存通过诱导或者感受细胞的凋亡。GAS-5在乳腺癌中大幅下调的暗示其可能作为抑癌基因存在[24]。snoRNAs与肿瘤的关系也能够延伸到与它们相互作用的蛋白分子上。根据它们结构与功能的不同,snoRNP复合物能够分为两类C/D box snoRNP和H/ACA box snoRNP。C/D box snoRNP 包含四种进化上保守的,必需的蛋白质,即纤维蛋白 (fibrillarin)/Nop1p、Nop56、Nop58/Nop5p和p15.5KD/ Snu13p,而H/ACA box snoRNP 的结合蛋白包括进化保守的Cbf5p(dyskerin)、Gar1p、Nhp2p 和Nop10p。fibrillarin是发育必须的,缺失fibrillarin能够导致胚胎致死。Dyskerin、NOP10以及Nhp2p的突变与上皮癌有关[25]。snoRNAs以及snoRNP很可能是通过影响核糖体和蛋白的翻译来影响肿瘤的发生的,因为在癌细胞中翻译过程总是异常的。但是snoRNAs也可能通过降解的短片段RNA来发挥miRNA功能进而调节基因的表达来影响肿瘤的发生。孤儿snoRNAs(目前还没有明确的靶基因)可能成为以后研究的热点。
snoRNAs作为癌症诊断和预后生物标志物
snoRNAs在细胞中的功能是多样的,肿瘤特异表达的snoRNAs可能作为癌症相关的生物标志物。研究报道snoRNAs能够在外周血浆以及血清中稳定存在且可测,这使snoRNAs作为潜在的循环肿瘤生物标志物成为可能(table1)[9]。在非小细胞肺癌中 SNORD33, SNORD66和SNORD76不仅在肿瘤中高表达并且在血浆中也检测到高表达,这使辨别非小细胞肺癌患者成为可能[21]。SNORA42虽在组织相关疾病的预后检测效果较差,但可以预测疾病[26]。近期的研究成果进一步表明snoRNAs作为生物标志物的巨大应用前途。他们发现SNORD43, SNORD44和SNORD48作为乳腺癌和头颈部鳞状细胞癌潜在的抑制剂[27]。U50能够抑制乳腺癌和前列腺癌(table1)[22, 23]。SNORD113-1在原发性肝细胞癌中表达下调并且在原发性肝细胞癌中作为抑癌基因发挥功能[28]。总之,snoRNAs可以作为癌症诊断和预后的潜在的生物标志物。
snoRNAs作为癌症治疗的潜在靶点
虽然snoRNAs在肿瘤中发挥功能的分子机制仍然不是很清楚,但其仍是作为基因干预治疗的潜在理想对象。由snoRNAs介导的基因沉默可能是最好的治疗手段。当然用RNAi介导的基因沉默来选择性的沉默相关致癌snoRNAs也是不错的方法。例如,snoRA42在肺癌中是高表达的,在肺癌细胞中选择性的沉默snoRNAs42,细胞的增殖能力和活力明显下降[26]。这些实验证据都表明snoRNAs可以作为癌症治疗的潜在靶点。
snoRNAs和其它疾病
snoRNAs与神经退行性疾病的关系也有报道[29, 30]。一系列独立的研究表明Prader Willi综合症是由于缺失来源于15号染色体15q11–q13区域所致,而此区域则包含两个snoRNAs家族成员:SNORD115 (HBII-52) 和SNORD116 (HBII-85)[31]。SNORD115可能影响大脑中5-HT2CR的mRNA水平[17]。SNORD116的缺失是导致Prader Willi综合症发病的主要原因。最近的一项研究表明,C/D box snoRNAs 表达水平的变化也发生在孕妇酒精消耗引起的异常胎儿大脑发育的过程中。特别注意的是在此过程中SNORD115表达上调,SNORD116表达下调[32]。SNORD115表达水平的变化导致了各种心理和行为畸变典型自闭症[33]。同时另外一项研究报道在病毒感染的细胞中一系列snoRNAs的表达水平在病毒感染后得到明显上调[34]。一方面snoRNAs可以作为受体抗病毒反应的调节者;另一方面,调控RNA的活性可以被病毒利用使其逃避天然免疫从而完成其生命周期[35]。
总结
在人类细胞中的,RNA的转录后修饰、mRNA的稳定性和翻译的控制是基因表达调控的重要组成部分。snoRNAs和它们产生的功能短片段RNA在这些过程中发挥着重要作用:它们指导核糖体RNA(rRNA)和核小RNA(snRNA)的修饰、影响其互补前体mRNA的剪接以及控制mRNA的翻译和稳定性。外界因素以及细胞内部的信号级联反应能够导致snoRNAs表达水平的变化,进而引起细胞水平的生理变化、器官功能障碍以及各种疾病。snoRNAs的结构,表达模式和在细胞中的定位具有重要的调控作用,被认为是病理诊断的标志物。snoRNAs表达水平和功能机制的研究将为人类疾病的诊断和治疗提供新的希望。
参考文献
1. Esteller, M., Non-coding RNAs in human disease. Nat Rev Genet, 2011. 12(12): p. 861-74.
2.
Kiss, T., et al., Biogenesis and intranuclear trafficking of human box
C/D and H/ACA RNPs. Cold Spring Harb Symp Quant Biol, 2006. 71: p.
407-17.
3. Williams, G.T. and F. Farzaneh, Are snoRNAss and snoRNAs
host genes new players in cancer? Nat Rev Cancer, 2012. 12(2): p. 84-8.
4.
Sahoo, T., et al., Prader-Willi phenotype caused by paternal deficiency
for the HBII-85 C/D box small nucleolar RNA cluster. Nat Genet, 2008.
40(6): p. 719-21.
5. Bhartiya, D., et al., Systematic curation and
analysis of genomic variations and their potential functional
consequences in snoRNAs loci. Hum Mutat, 2012. 33(10): p. E2367-74.
6.
Bellodi, C., et al., H/ACA small RNA dysfunctions in disease reveal key
roles for noncoding RNA modifications in hematopoietic stem cell
differentiation. Cell Rep, 2013. 3(5): p. 1493-502.
7. Michel, C.I.,
et al., Small nucleolar RNAs U32a, U33, and U35a are critical mediators
of metabolic stress. Cell Metab, 2011. 14(1): p. 33-44.
8. Youssef,
O.A., et al., Potential role for snoRNAss in PKR activation during
metabolic stress. Proc Natl Acad Sci U S A, 2015. 112(16): p. 5023-8.
9. Mannoor, K., J. Liao, and F. Jiang, Small nucleolar RNAs in cancer. Biochim Biophys Acta, 2012. 1826(1): p. 121-8.
10.
Smith, C.M. and J.A. Steitz, Classification of gas5 as a
multi-small-nucleolar-RNA (snoRNAs) host gene and a member of the
5'-terminal oligopyrimidine gene family reveals common features of
snoRNAs host genes. Mol Cell Biol, 1998. 18(12): p. 6897-909.
11.
Panse, V.G. and A.W. Johnson, Maturation of eukaryotic ribosomes:
acquisition of functionality. Trends Biochem Sci, 2010. 35(5): p. 260-6.
12.
Thorenoor, N. and O. Slaby, Small nucleolar RNAs functioning and
potential roles in cancer. Tumour Biol, 2015. 36(1): p. 41-53.
13. Kiss, T., Small nucleolar RNA-guided post-transcriptional modification of cellular RNAs. EMBO J, 2001. 20(14): p. 3617-22.
14.
Ganot, P., M.L. Bortolin, and T. Kiss, Site-specific pseudouridine
formation in preribosomal RNA is guided by small nucleolar RNAs. Cell,
1997. 89(5): p. 799-809.
15. Ender, C., et al., A human snoRNAs with microRNA-like functions. Mol Cell, 2008. 32(4): p. 519-28.
16.
Brameier, M., et al., Human C/D box snoRNAss with miRNA like functions:
expanding the range of regulatory RNAs. Nucleic Acids Res, 2011. 39(2):
p. 675-86.
17. Kishore, S. and S. Stamm, The snoRNAs HBII-52
regulates alternative splicing of the serotonin receptor 2C. Science,
2006. 311(5758): p. 230-2.
18. Liu, Z.H., et al., Small ncRNA
expression and regulation under hypoxia in neural progenitor cells. Cell
Mol Neurobiol, 2011. 31(1): p. 1-5.
19. Makarova, J.A., et al., New functions of small nucleolar RNAs. Biochemistry (Mosc), 2013. 78(6): p. 638-50.
20.
Chang, L.S., et al., Differential expression of human 5S snoRNAs genes.
Biochem Biophys Res Commun, 2002. 299(2): p. 196-200.
21. Liao, J., et al., Small nucleolar RNA signatures as biomarkers for non-small-cell lung cancer. Mol Cancer, 2010. 9: p. 198.
22. Dong, X.Y., et al., Implication of snoRNAs U50 in human breast cancer. J Genet Genomics, 2009. 36(8): p. 447-54.
23.
Dong, X.Y., et al., SnoRNAs U50 is a candidate tumor-suppressor gene at
6q14.3 with a mutation associated with clinically significant prostate
cancer. Hum Mol Genet, 2008. 17(7): p. 1031-42.
24.
Mourtada-Maarabouni, M., et al., Growth arrest in human T-cells is
controlled by the non-coding RNA growth-arrest-specific transcript 5
(GAS5). J Cell Sci, 2008. 121(Pt 7): p. 939-46.
25. Gupta, V. and A. Kumar, Dyskeratosis congenita. Adv Exp Med Biol, 2010. 685: p. 215-9.
26. Mei, Y.P., et al., Small nucleolar RNA 42 acts as an oncogene in lung tumorigenesis. Oncogene, 2012. 31(22): p. 2794-804.
27.
Gee, H.E., et al., The small-nucleolar RNAs commonly used for microRNA
normalisation correlate with tumour pathology and prognosis. Br J
Cancer, 2011. 104(7): p. 1168-77.
28. Xu, G., et al., Small nucleolar
RNA 113-1 suppresses tumorigenesis in hepatocellular carcinoma. Mol
Cancer, 2014. 13: p. 216.
29. Doe, C.M., et al., Loss of the
imprinted snoRNAs mbii-52 leads to increased 5htr2c pre-RNA editing and
altered 5HT2CR-mediated behaviour. Hum Mol Genet, 2009. 18(12): p.
2140-8.
30. Sridhar, P., H.H. Gan, and T. Schlick, A computational
screen for C/D box snoRNAss in the human genomic region associated with
Prader-Willi and Angelman syndromes. J Biomed Sci, 2008. 15(6): p.
697-705.
31. Cavaille, J., et al., Identification of brain-specific
and imprinted small nucleolar RNA genes exhibiting an unusual genomic
organization. Proc Natl Acad Sci U S A, 2000. 97(26): p. 14311-6.
32.
Laufer, B.I., et al., Long-lasting alterations to DNA methylation and
ncRNAs could underlie the effects of fetal alcohol exposure in mice. Dis
Model Mech, 2013. 6(4): p. 977-92.
33. Nakatani, J., et al.,
Abnormal behavior in a chromosome-engineered mouse model for human
15q11-13 duplication seen in autism. Cell, 2009. 137(7): p. 1235-46.
34.
Saxena, T., et al., Combined miRNA and mRNA signature identifies key
molecular players and pathways involved in chikungunya virus infection
in human cells. PLoS One, 2013. 8(11): p. e79886.
35. Cullen, B.R., MicroRNAs as mediators of viral evasion of the immune system. Nat Immunol, 2013. 14(3): p. 205-10.
-
企业风采

-
企业风采

-
焦点事件

-
科技前沿

-
科技前沿

-
项目成果
-
焦点事件

-
焦点事件

-
技术原理
-
项目成果
-
焦点事件

-
项目成果