揭示H3K4me1参与RdDM途径的分子机制
2021年6月7日,Nature Communications在线发表了来自中国科学院分子植物科学卓越创新中心上海植物逆境生物学研究中心郎曌博研究组和南方科技大学杜嘉木研究组合作完成的题为“Ahistone H3K4me1-specific binding protein is required for siRNA accumulation andDNA methylation at a subset of loci targeted by RNA-directed DNA methylation”的研究论文。该研究通过遗传筛选和功能鉴定发现了一个新的RdDM途径蛋白RDM15。该蛋白为组蛋白H3K4me1的阅读器,并揭示其参与RdDM途径的分子机制。
RNA介导的DNA甲基化是植物小RNA参与表观调控的重要方式,其需要两个植物特有的RNA聚合酶Pol IV(大亚基NRPD1为催化核心)和Pol V(大亚基NRPE1为催化核心)以及大量的辅助蛋白。RdDM可以在转录水平抑制转座子和基因,并参与到植物生物和非生物胁迫、植株再生、植物生长和果实成熟发育等生物学调控过程。
植物RdDM途径,Pol IV的招募需要具有可以结合H3K4me0和H3K9me的SWADEE domain的SHH1蛋白的协助。RdDM的作用位点可以被激活型组蛋白修饰(H3K4me2/ H3K4me3)所释放。虽然RdDM途径跟组蛋白修饰之间的相互关系已经有了深入的研究,但是现有的分子机制并不能完全阐述组蛋白修饰跟RdDM作用位点的调控关系。
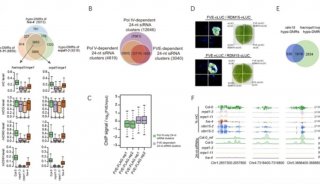
在本研究中,科研人员通过正向遗传学筛选到了参与基因沉默的突变体,通过克隆发现是具有Tudor domain的基因RDM15功能缺失造成的。通过甲基化测序和DMR的分析发现,RDM15影响的甲基化位点是RdDM作用位点。在RDM15突变体中DNA甲基化水平的变化伴随着相同趋势的小干扰RNA水平的变化。研究结果确认了RDM15是RdDM途径中的一个组分。通过免疫沉淀和质谱联用的方法,进一步鉴定出RDM15是NRPE3B (Pol V的亚基)的互作组分。通过BiFC和Split-LUC实验进一步确认了其互作关系。从而确认了RDM15是通过招募Pol V来影响RDM15位点上的DNA甲基化。
通过对RDM15进行组蛋白肽段微阵列实验,发现RDM15可以特异性的结合H3K4me1。利用ChIP-seq对RDM15的结合位点进行了分析,首先确认了RDM15在RDM15依赖的siRNA上有明显的富集。同时通过对H3K4me1/ H3K4me2/ H3K4me3的分布比较分析后发现,RDM15在基因组的结合位点上的组蛋白修饰为H3K4me1,而非H3K4me2或H3K4me3修饰。利用等温滴定量热的方法(ITC)进一步确认了RDM15的Tudor结构域对组蛋白H3K4me1具有很高的识别特异性。通过对RDM15 Tudor结构域和H3K4me1复合物的共结晶的筛选,发现组蛋白H3的第二位精氨酸(H3R2)和一甲基化修饰的赖氨酸(H3K4me1)残基可以被氢键网络、静电相互作用,以及一个用于捕获识别甲基化修饰的赖氨酸的芳香笼结构特异性识别。利用突变的Tudor结构域跟H3K4me1的ITC结合曲线以及体内Co-IP的实验进一步验证了论文的观点。综上,该工作发现了一个新的H3K4me1识别蛋白RDM15,其通过招募Pol V来参与RNA介导的DNA甲基化过程的新机制。

RDM15通过识别H3K4me1来参与RdDM途径甲基化调控的分子机制。通过对RDM15结构分析和ITC实验,证实RDM15可以特异性的结合H3K4me1。通过甲基化测序和蛋白互作研究进一步证实RDM15是通过招募Pol V来影响RDM15位点上的DNA甲基化。
中国科学院分子植物科学卓越创新中心上海植物逆境生物学研究中心的郎曌博研究员和南方科技大学杜嘉木研究员为本论文的通讯作者,中心的牛庆丰博士和宋哲博士为本文的共同第一作者。该工作得到了中国科学院先导B项目、植物分子遗传国家重点实验室和国家自然科学基金等经费的资助。
-
科技前沿
-
科技前沿










