CAR-T细胞治疗相关细胞因子释放综合征,了解一下!
2017年美国食品药品监督管理局(FDA)批准了两种抗CD19的CAR-T细胞(Kymriah 及Yescarta)产品用于治疗难治复发性急性B淋巴细胞白血病及B细胞非霍奇金淋巴瘤,标志着CAR-T细胞疗法在肿瘤治疗领域的全面正式开启。
CAR-T细胞免疫疗法应答率显著,但在治疗过程中经常会出现严重的毒性作用,其中细胞因子释放综合征(CRS)是发生最频繁、症状最突出的急性不良反应,严重时可危及生命。因此,正确有效地对CRS进行管理和干预,降低CAR-T治疗相关不良事件发生率是亟待解决的临床问题。
CRS的临床表现
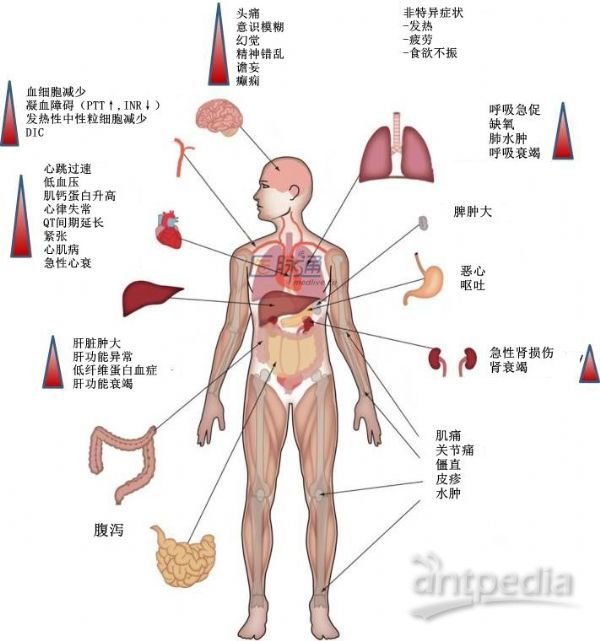
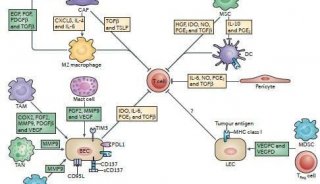
CRS是CAR-T细胞接触带有肿瘤抗原的细胞后大量增殖,并对肿瘤细胞大量杀伤,在此过程中产生一系列细胞因子,形成细胞因子风暴,对患者身体造成系列性相关损害的综合征。CRS临床表现多样,主要有高热、乏力、疲劳、肌痛、恶心、厌食、心动过速、低血压、毛细血管渗漏、心功能不全、肾损害、肝衰竭、弥漫性血管内凝血等(见图1)。
图1 CRS临床表现(从发热和非特异性症状开始,CRS可影响多个器官系统)
CRS的诊断、严重程度分级和鉴别诊断
1、诊断和分级
在CAR-T细胞输注后3周内,若出现下列症状之一则应考虑可能发生CRS:①体温≥38 ℃;②低血压(收缩压<90 mmHg);③低氧血症(动脉氧饱和度<90%);④脏器毒性反应。
CRS通常发生在应用CAR-T疗法后的第1周内,且于1~2周内达到高峰。CRS严重程度分级目前主要有两种标准,第一种主要是根据Lee等对免疫治疗所致CRS相关不良事件评估标准(NCI CTC AE 4.0)加以修正以适用于T细胞治疗所致CRS的评估标准进行评定(表1)。
表1 CRS分级标准
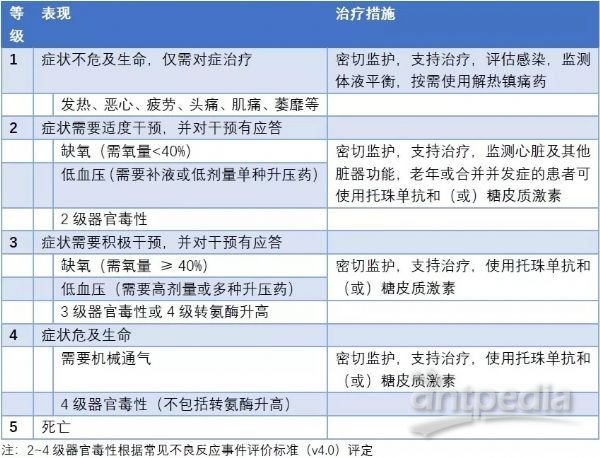
第二种分级标准更为简明扼要,具有可操作性。1级:只需接受支持治疗的轻度症状;2 级:存在需要住院治疗或者静脉治疗的器官功能障碍;3 级:出现需要静脉输液或者低剂量升压药物治疗的低血压,需冷沉淀或血浆输注治疗的凝血障碍以及需要高流量吸氧或无创机械通气的低氧表现;4 级:出现需要高剂量升压药物、有创机械通气治疗的威胁生命的症状。
一旦发生3级以上CRS,若不及时干预则有可能危及生命。为了能早期识别sCRS的发生,Davila等将实验室数据和临床特征相结合,根据发热持续时间、CRS相关细胞因子的增高程度及临床毒性症状提出严重CRS(sCRS)的诊断标准,包括:发热持续3 d 以上;两种细胞因子水平升高75 倍以上或1 种细胞因子水平升高至少250倍;存在低血压(至少需要1 种静脉升压药治疗)、缺氧(氧分压<90%)或神经系统症状。一旦发生上述情况,建议尽早介入干预。
2、鉴别诊断
在临床上CRS可表现为非特异性综合征从而造成诊断困难,区分CRS和其他炎症性疾病非常重要,因为一些炎症性疾病与CRS有相似的临床症状和体征,但是需要不同的治疗手段。肿瘤溶解综合征(TLS)的临床表现可与CRS相似,表现为发热,急性肾衰竭,心律失常和癫痫等。尽管肿瘤溶解综合征依据特征性实验室异常,例如高尿酸血症,高钾血症,高磷血症和低钙血症等,容易与CRS区分,但是有时很难确定CRS和肿瘤溶解综合征是否为同时发生。
CRS患者感染风险很高,多数感染发生在CAR-T细胞输注早期,CRS的严重程度是感染的最重要的危险因素。CRS的免疫抑制疗法可掩盖一些感染的征象,从而延迟感染的诊断和治疗。如果怀疑患者感染,应快速开始经验性抗菌治疗。所有CRS患者均应接受包括X线和血培养检查来排除感染。此外,在开始免疫治疗前还需仔细检查患者是否存在感染迹象。
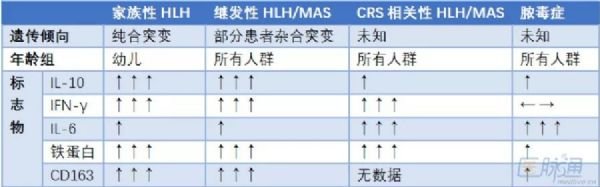
嗜血细胞性淋巴组织细胞增生症(HLH)/巨噬细胞活化综合征(MAS)样综合征通常为sCRS的表现,CRS相关性HLH与原发性HLH或脓毒症难以鉴别,CRS相关性HLH/MAS的鉴别诊断见(表2)。
表2 CRS相关性HLH/MAS的鉴别诊断
CRS的管理策略
1、CRS的监测和一般处理
CRS毒性症状常在细胞输注后1周内出现,在细胞输注后1~2周内达到最高峰。在此期间,CRS的监测包括常规心电监护(每隔2~4 h记录生命体征)、每日检测血常规及血细胞计数、出凝血常规、CRP、铁蛋白浓度和生化等。若条件允许,每隔2 d检测包括IL-6、IL-10及IFN-γ等血清细胞因子浓度和流式细胞术检测外周血CD19+B细胞和CD3+T细胞的比例变化。对具有发生sCRS高危因素(基线期高肿瘤负荷、血小板减少及CAR-T细胞输注后3 d内发热)的患者须加强监护,必要时可每日检测2次血细胞计数、生化及出凝血常规等。密切监测患者液体出入量和体重变化,补充液体以静脉补液为主,建议使用带有2或3腔导管的中心静脉通路。每日2~3次根据CARTOX-10评分评估患者神经系统功能。高热患者可服用非甾体类解热镇痛药,首选对乙酰氨基酚片,并使用冰袋、冰帽及冰毯等辅助降温。因糖皮质激素可能会抑制CAR-T细胞功能,发热时尽量避免使用此类药物,但若在使用各种退热措施后仍高热持续不退,应警惕发生sCRS可能,需进一步加强观察患者生命体征变化及监测各脏器功能,对有发生sCRS高危因素的患者应尽早使用IL-6拮抗剂或激素。
2、CRS分级管理措施
CRS是CAR-T细胞治疗中最常见的不良反应之一,其本质是一种免疫反应,由于多种细胞因子水平升高而引发各种临床症状。轻度CRS仅仅表现为一过性的发热、疲劳、肌痛、恶心等,常可自行缓解,无需特殊治疗。中重度CRS可以表现为呼吸困难、进展性低血压、急性肾衰竭、神经精神系统异常等,此时不仅需要对症进行机械通气、升压、透析等治疗,还需要针对CRS的本质进行免疫抑制治疗,以有效控制CRS的进展。根据CRS分级情况进行处理(表3)。
表3 CAR-T细胞治疗相关CRS分级管理
3、sCRS的治疗
(1)托珠单抗:
建议发生3级CRS或发生2级CRS的老年患者或合并其他疾病患者,应尽早使用托珠单抗,该措施最终目的是避免发生危及生命的4~5级CRS。托珠单抗起始剂量通常为8 mg/kg,输注时间为1 h,最大剂量不超过800 mg。若初次使用托珠单抗后未能改善CRS引起的临床症状,需排除其他引起临床症状恶化的原因(如TLS、败血症、肾上腺功能不全等)。在有效提供血流动力学及呼吸支持以外,可第二次使用托珠单抗或其他免疫抑制剂治疗,如糖皮质激素。
(2)糖皮质激素及其他免疫抑制剂:
目前糖皮质激素仅用于托珠单抗无法改善的sCRS,除糖皮质激素外,必要时可使用司妥昔单抗或依那西普等免疫抑制剂。如果CRS仍无好转,可考虑抗T细胞治疗,如环磷酰胺、抗胸腺细胞球蛋白或阿仑单抗等。
小结
CAR-T细胞治疗中出现的CRS症状往往变化多端、错综复杂,因而,需要医护人员对免疫疗法所致的独特不良反应充分认识及精确评估,一旦出现sCRS征兆,应及时并强力干预以减轻脏器毒性,托珠单抗和激素是其中最为关键的两类药物。CRS管理的最终目标是在保持CAR-T细胞治疗最大疗效的同时防止可能威胁生命的CRS发生,但由于激素的使用可能影响CAR-T细胞治疗的长期疗效,如何合理运用激素或选择更合适的药物治疗sCRS还有待进一步的临床研究。