武大长江学者李红良Nature医学再发新成果
武汉大学的研究人员在新研究中证实,一个心脏富集的长非编码(lnc)RNA——被称为心肌肥厚相关表观遗传学调节因子(Chaer),对于心肌肥厚的发展是至关重要的。这一研究成果发布在9月12日的《自然医学》(Nature Medicine)杂志上。
领导这一研究的是武汉大学心血管病研究所副所长李红良(Hongliang Li)教授,他是国家杰出青年基金获得者、“长江学者”特聘教授、入选科技部中青年科技创新领军人才、教育部新世纪优秀人才计划、湖北省高端人才计划。 李红良近十余年来一直致力于心血管代谢性疾病的研究,围绕天然免疫调控网络对心血管代谢性疾病的作用,进行了深入的研究与探讨,取得了一系列重要研究成 果,发表国际期刊论文100余篇,发表论文SCI总引用次数近3000次,并入选2014、2015年中国高被引学者榜单(医学)。
目前心脑血管疾病已成为危害我国人民身体健康的“头号杀手”,因心脑血管疾病死亡人数占总死亡人数的比例呈迅速上升趋势,且越来越趋于年轻化。病理 性心肌肥厚(pathological cardiac hypertrophy)是许多心血管疾病如高血压、冠心病、瓣膜疾病等终末期共同的病理生理表现,现有研究已经公认病理性心肌肥厚是心衰的前期病变,是 心衰、脑卒中、冠心病、猝死等的独立危险因素。
表观遗传重编程是心肌肥厚和重塑过程中病理性基因诱导的一个关键过程,但是潜在的调控机制仍有待于阐明。在这项研究中,研究人员确定了一个心脏富集 的长非编码(lnc)RNA——被称为心肌肥厚相关表观遗传学调节因子(Chaer),对于心肌肥厚的发展是至关重要的。从机制上来看,Chaer与多梳 抑制复合物2(PRC2)的催化亚基直接相互作用。这种相互作用,是由Chaer中的一个66-mer的序列介导的,干扰了PRC2靶向基因组位点,从而抑制了心肌肥厚相关基因启动子区上的组蛋白H3赖氨酸27甲基化。
Chaer和PRC2之间的相互作用是在一个涉及哺乳动物雷帕霉素靶点复合物1的过程中,在激素或应激刺激后瞬时诱导的,这种相互作用是心肌肥厚相 关基因的表观遗传重编程和诱导的一个先决条件。在压力负荷开始之前——而不是之后,抑制Chaer在心脏的表达,可大幅度减轻心肌肥厚和功能障碍。这项研 究表明,压力诱导的病理性基因在心脏中被激活,需要一个以前未知的lncRNA相关表观遗传学检查点。
这已经是李红良教授今年发表的第四项研究成果,2月17日,他带来的研究小组在《Nature Communications》杂志发表论文证实,肝细胞TRAF3通过靶向TAK1依赖性信号促进了肝脂肪变性和全身性胰岛素抵抗。
6月份,李红良教授领导的研究小组在病理性心肌肥厚的研究中取得重大突破,两篇研究论文发表在同日(6月1号)的《自然通讯》(Nature Communications)杂志上。
-
焦点事件

-
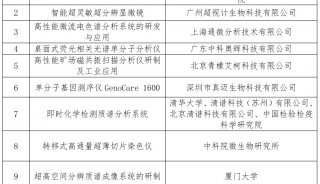
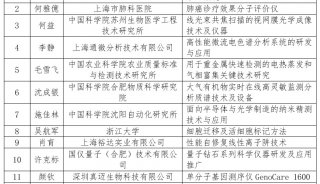
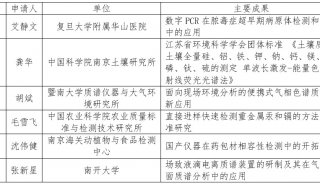
项目成果
-
焦点事件

-
焦点事件