荧光标记基团的选择及其在荧光定量PCR中的应用
PCR实验室产品选择指南
荧光 基团是吸收一定波长的光子后发射特定波长的光波,可以作为抗体等分子的标记物,实时荧光定量PCR中的Taqman探针常用荧光基团FAM标记荧光基团和TAMRA标记。
荧光基团
吸收特定波长的光子后荧光染料(通常称为“荧光基团”或简称为“荧光素”)的化学键即被活化,其化学键活化的结果是发射波长更长的光子(能量更低)同时染料分子转变为基态。
经常使用小的、化学稳定性好的荧光基团作为抗体和其他生物分子的标签或标记物,这样的荧光基团一般应具有合适的、高效的(强烈的)激发和发射波长范围。可以修饰荧光基团分子使其能够共价地连接到蛋白、核酸和其他生物分子上。
荧光标记的(荧光的)探针广泛地应用于通过荧光显微镜 、流式细胞技术或其他荧光读取设备检测蛋白。
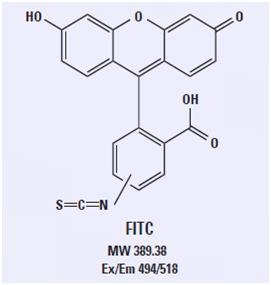
荧光素异硫氰酸酯(fit C)的结构
这种广泛使用的荧光素衍生物染料含有三个环状结构,此结构赋予该分子荧光特性。对荧光素复合物的修饰是加入了异硫氰酸酯基团,通过该基团可以实现与抗体及其他含有氨基的探针的共价连接。

绿色、黄色和红色荧光染料的激发和发射光谱。DyLight488、549和649是替代荧光素(绿色), 罗丹明 (红色)和其他传统荧光染料的高强度、光稳定性好的荧光染料。我们提供标记的二抗和链亲和素偶联物,还提供用于标记其他蛋白的同氨基、巯基反应的这些荧光素衍生物。
荧光标记
荧光标记是将荧光基团共价连接到蛋白、核酸等分子上的过程。通常使用能够选择性地与目标分子上存在的功能基团反应的荧光素基团衍生物来完成这样的过程。最常见的标记过的分子是抗体,经常使用标记过的抗体来检测特定的目标分子。
可在多种检测系统中使用荧光标记来实现灵敏和定量的检测。经常使用具有化学反应活性的荧光基团衍生物来实现荧光标记。通常的反应活性基团包括与氨基反应的异硫氰酸酯衍生物,如FITC和TRITC(荧光素和罗丹明的衍生物);和氨基反应的琥珀酰亚胺酯,如NHS-荧光素或NHS-罗丹明;以及和巯基反应的马来酰亚胺活化的荧光素,如荧光素-5-马来酰亚胺。
这些具有反应活性的染料与其他分子进行反应会在荧光基团和标记的分子之间形成稳定的共价键。长久以来一直将异硫氰酸酯作为连接荧光染料和蛋白赖氨酸侧链上的伯胺的首选化合物,但是该化合物仍存在一些缺点。
目前的标记方法中多选择NHS-酯化合物,这是由于该化合物具有针对伯胺的更高特异性并且能够形成更稳定的连接。与巯基反应的化合物在蛋白质标记的化合物中占有一小部分,经常在需要保存赖氨酸残基或者需要特异在蛋白上的半胱氨酸残基上标记荧光染料时使用这种化合物。
在荧光标记反应之后经常需要从标记过的靶分子中去除未反应的荧光基团。通常根据荧光基团与标记的蛋白或者核酸等分子之间的分子量差距,通过分子筛来去除未反应的荧光基团。
然而,很多荧光基团会与许多传统的分离介质产生相互作用从而导致分离和回收的效率很低。因此优选的染料去除柱是根据荧光染料的疏水特性而设计的。
荧光染料的选择
生命科学研究中使用的一些基于荧光的系统中经常使用荧光蛋白(例如,藻红蛋白)或生物发光报告系统。然而,这些技术非常耗时而且无法检测多个目标,同时与合成的荧光染料相比其灵敏度及光稳定性都不够好。
使用荧光染料标记的特异性探针的荧光技术能够在基于细胞的应用中检测多个目标,并且与多种荧光设备兼容。虽然在生物学应用中荧光素、罗丹明及AMCA染料已经使用了很长时间,但是这些染料仍然有其局限性。
最值得注意的是由于这些传统染料的荧光强度较低,因此限制了大多数应用的灵敏性;另外由于这些染料易被光漂白,因此限制了通常应用的灵敏度,并且限制了共聚焦显微镜应用中的景深及时差显微技术中的曝光。新一代的荧光基团可以超越这些传统的染料的限制。
Thermo ScientificDyLight荧光素在亮度、光稳定性以及pH灵敏性等方面都有极大的提高。除了这些优点以外,新一代的荧光基团还能够覆盖全部的可见光谱及大部分红外光谱。
荧光标记应用实例:实时定量PCR技术综述(原理、荧光标记、TaqMan Probes和Hybridization Probes)
一.实时定量PCR基本原理
1.PCR反应动力学
右图为PCR反应曲线(横坐标为循环数,纵坐标表征产物量),不同的曲线代表初始模板量不同的 PCR反应。PCR反应的动力学公式为:
Cn=C0(1+E)n
其中C0和Cn分别为初始模板和n循环的拷贝数,n为循环数,E为扩增效率(0≤E≤1),理想状态下(即每个循环中所有模板均与引物结合并等到扩增),E为1。

由上图可知,只有在线性区段E值才为定值,这样才能通过检测Cn定量C0,由于终点检测不能保证在线性区段,所以重复性不好,实时检测(每个循环检测一次)技术解决了这个问题。
2.定量PCR原理

定量PCR是将待测标本与一系列浓度(C0)已知的标准品在同一条件下共同扩增,并进行实时检测,根据标准品的检测值及已知的C0值作出标准曲线,如右图(横作标为的C0对数值),再根据待测标本的检测值在标准曲线上查到待测标本的C0值。
3.信号产生
目前定量PCR技术信号产生都是基于 FRET (fluorescence resonance energy transfer)的原理,即在一定波长的光激发下,一个荧光基团A发光,并且被邻近的另一个荧光基团B吸收,使荧光基团B发光。如检测荧光基团A,应在FRET消除后;如检测B,则应在FRET发生时检测。
根据信号产生方式的不同可将定量PCR技术分为三类:TaqMan Probes技术;Hybridization Probes技术;Molecular Beacons技术。
TaqMan Probes技术(右图A)是Perkin
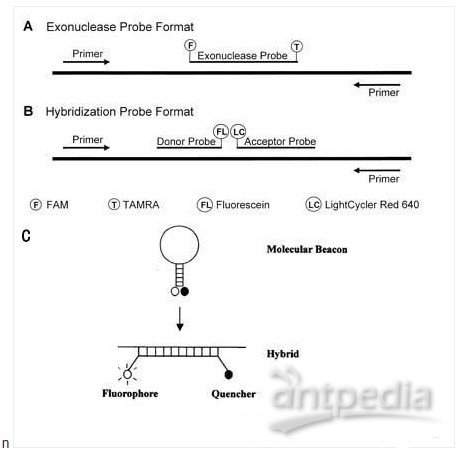
Elmer公司1995年研制,利用热稳定DNA聚合酶5’→3’外切酶活性,将TaqMan 探针 5’端荧光基团切去,使之与3’端荧光基团分离、荧光淬灭消失,在特定波长下检测5’端荧光基团即可表征PCR产物的量。
Hybridization Probes技术(右图B)是Roche公司建立的,PCR反应退火过程中,两个探针与模板杂交(相邻一个碱基),发生FRET,这时检测第二个荧光基团即可表征PCR产物的量。Hybridization Probes技术要求热稳定DNA 聚合酶不具备5’→3’外切酶活性,而是在引物延伸过程中被取代,使探针可在下一循环再与模板杂交,如探针被降解,可导致定量不准。
Molecular Beacons技术(上图C)利用茎环结构的探针,当形成茎环结构时,发生荧光淬灭,退火过程中,探针与模板杂交,荧光淬灭消失,在特定波长下检测5’端荧光基团即可表征PCR产物的量。
二.荧光标记
1.TaqMan Probes
TaqMan探针通常在5’端以荧光基团FAM标记,靠近 3’端以荧光基团TAMRA标记,3’端磷酸化以防止探针在PCR扩增过程中被延伸。下表列出了两种荧光基团的吸收及发射波长。
| FAM | TAMRA | |
| 吸收波长 | 492 | 547 |
| 发射波长 | 518 | 573 |
2.Hybridization Probes
Hybridization探针技术中,上游donor Probe 3’端以荧光基团Fluorescein标记;下游acceptor Probe 5’端以Roche的LC-Red 640标记(当用双荧光基团时还可同时使用LC-Red 705),3’端磷酸化以防止探针在PCR扩增过程中被延伸。也有文献报道acceptor Probe 5’端以Cy5标记,下表列出了各种荧光基团的吸收及发射波长。
| Fluorescein | LC-Red 640 | LC-Red 705 | Cy5 | |
| 吸收波长 | 494 | 625 | 685 | 643 |
| 发射波长 | 519 | 640 | 705 | 667 |
3.荧光标记基团与PCR仪的激发与检测波长
由于荧光标记基团的选择还受到定量PCR仪所提供的激发和检测波长的制约,所以这里介绍一下临床应用中主流机型所提供的检测波长,见下表。
| GeneAmp 5700SDS | ABI Prism7700(适用于科研) | LightCycler | |
| 检测波长 | 530nm | 500-660nm | 530nm;640nm;705nm |
三.TaqMan Probes技术要点
TaqMan Probes技术要求所用的热稳定DNA聚合酶不但要具有5’→3’外切酶活性,而且要求所获得的扩增曲线符合PCR反应动力学。
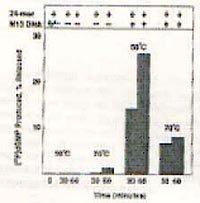
Matthew J.Longley等(1990)研究了热稳定DNA聚合酶的5’→3’外切酶活性,认为:(1)其5’→3’外切酶活性和DNA聚合酶活性位于同一肽段;(2)5’→3’外切酶活性依赖于双链DNA(如右图);(3)5’→3’外切酶活性具有热稳定性,之所以70℃较50℃活性低(如右图)是由于高温破坏了探针与模板间的双链结构。
K-A.Kreuzer等(2000)研究了15种热稳定DNA聚合酶(商品)的5’→3’外切酶活性,其中7种声称具有5’→3’外切酶活性,右图是这7种酶的定量PCR反应(TaqMan)曲线,其中部分酶没有5’→3’外切酶活性、部分酶具有较弱的5’→3’ 外切酶活性、只有一种酶的扩增曲线(A)符合PCR反应动力学。

下表列出了部分文献报道的TaqMan Probes技术所使用的酶和其它相关参数。
| Target | P1 | P2 | Probe | Enzyme | 退火温度 | 延伸温度 |
| HCV | 19 | 25 | 27 | AmpliTaq DNA polymerase | 60℃ | 60℃ |
| HIV | 19 | 22 | 32 | AmpliTaq Gold polymerase(Perkin-Elmer) | 60℃ | 60℃ |
| Albumin | 22 | 22 | 26 | AmpliTaq Gold polymerase(Perkin-Elmer) | 65℃ | 65℃ |
| 16S rRNA | 27 | 26 | 28 | Taq DNA polymerase | 62℃ | 62℃ |
| gB gene | 18 | 18 | 27 | AmpliTaq Gold polymerase (Perkin-Elmer) | 58℃ | 58℃ |
| omlA | 22 | 22 | 21 | AmpliTaq Gold polymerase (Perkin-Elmer) | 62℃ | 62℃ |
| lytA | 21 | 21 | 25 | Taq DNA polymerase | 60℃ | 60℃ |
四.Hybridization Probes技术要点
Hybridization探针技术要求所用的热稳定 DNA聚合酶没有5’→3’外切酶活性,以保证探针有恒定的浓度并能反复与模板杂交。
Jochen,Wilhelm等(2001)研究了Taq酶 5’→3’外切酶活性对基于Hybridization探针技术的定量PCR的影响,认为:
(1)Taq酶5’→3’外切酶活性降解了部分探针;
(2)Taq酶的stoffel片段(去除N端289个氨基酸)不具有5’→3’外切酶活性,其在高浓度Mg2+存在下,能获得较好的PCR动力学曲线(如下图);(3)stoffel片段因高Mg2+浓度造成的非特异性扩增可采用加入TaqStart antibody的方式消除。
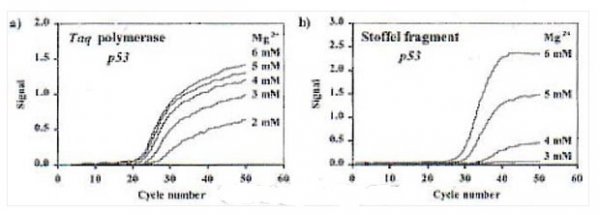
五.TaqMan 探针与Hybridization探针技术的比较
1. Hybridization探针技术的特异性高于TaqMan探针,因其信号的产生依赖于两个独立探针的特异性。但其在探针设计上需要更多的可选序列;
2. TaqMan探针技术的开放性优于Hybridization探针技术,原因有二:
(1)TaqMan探针技术的荧光标记系统是开放的,易从第三方获得,而Hybridization探针的荧光染料为罗氏专有,易受其控制;
(2)TaqMan探针和Hybridization探针分别在ABI Prism7700和罗氏LightCycler上建立,因荧光标记和仪器检测波长的不同,限制了其在两种仪器上的通用性,目前已有文献报道将 TaqMan探针用在LightCycler上,但未见报道Hybridization探针用在ABI Prism7700上,可能是ABI Prism7700价格较贵,不适合临床应用,而ABI GeneAmp 5700SDS只有一个检测波长(530nm);也可能Hybridization探针依赖于LightCycler的快速扩增。
3. Hybridization 探针分别标记两个探针,和TaqMan探针的同一探针三种修饰相比,修饰技术要求低,对修饰的质量控制更有利。
实时荧光定量PCR技术科根据信号产生的不同,可以分为TaqMan Probes、Hybridization Probes、Molecular Beacons三类,其中Taqman探针常用5‘荧光基团FAM标记和3‘荧光基团和TAMRA标记,Hybridization Pro常用荧光基团Fluorescein标标记 3’端,常用Roche的LC-Red 640标记标记5'端。