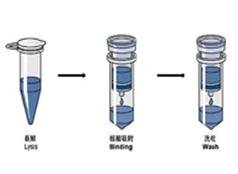
TRIzol法同时提取RNA、DNA、蛋白质(一)
TRIzol试剂适用于从细胞和组织中快速分离RNA。TRIzol试剂有多组分分离作用,与其他方法如硫氰酸胍/酚法、酚/SDS法、盐酸胍法、硫氰酸胍法等相比,最大特点是可同时分离一个样品的RNA\DNA\蛋白质.TRIzol使样品匀浆化,细胞裂解,溶解细胞内含物,同时因含有RNase抑制剂可保持RNA的完整性。在加入氯仿离心后,溶液分为水相和有机相,RNA在水相中。取出水相用异丙醇沉淀可回收RNA;用乙醇沉淀中间层可回收DNA;用异丙醇沉淀有机相可回收蛋白质。
RNA的提取
准备试剂:氯仿,异丙醇,75℅乙醇,无RNase的水或0.5℅SDS(溶液均需用DEPC处理过的水配制)。
操作步骤:
1. 匀浆处理:
a.组织将组织在液氮中磨碎,每50~100mg组织加入1ml TRIzol,用匀浆仪进行匀浆处理。样品体积不应超过TRIzol体积10℅。
b.单层培养细胞 直接在培养板中加入TRIzol裂解细胞,每250px2面积(即87.5px直径的培养板)加1ml,用移液器吸打几次。TRIzol的用量应根据培养板面积而定,不取决于细胞数。TRIzol加量不足可能导致提取的RNA有DNA污染。
c.细胞悬液离心收集细胞,每5~10×106动物、植物、酵母细胞或1×107细菌细胞加入1mlTRIzol,反复吸打。加TRIzol之前不要洗涤细胞以免mRNA降解。一些酵母和细菌细胞需用匀浆仪处理。
2.将匀浆样品在室温(15~30℃)放置5分钟,使核酸蛋白复合物完全分离。
3. 每使用1ml TRIzol加入0.2ml氯仿,剧烈振荡15秒,室温放置3分钟。(我们是5分钟)
4. 2-8℃10000×g离心15分钟。样品分为三层:底层为黄色(我们见到的是红色)有机相,上层为无色水相和一个中间层。RNA主要在水相中,水相体积约为所用TRIzol试剂的60℅。
5. 把水相转移到新管中,如要分离DNA和蛋白质可保留有机相,进一步操作见后。用异丙醇沉淀水相中的RNA。每使用1mlTRIzol加入0.5ml异丙醇(加入移出液相等体积),室温放置10分钟。
6. 2~8℃10000×g离心10分钟,离心前看不出RNA沉淀,离心后在管侧和管底出现胶状沉淀。移去上清。
8. 用75℅乙醇洗涤RNA沉淀。每使用1ml TRIzol至少加1ml 75℅乙醇。2~8℃不超过7500×g离心5分钟,弃上清。
9.室温放置干燥或真空抽干RNA沉淀,大约晾5~10分钟即可.不要真空离心干燥,过于干燥会导致RNA的溶解性大大降低。加入25~200μl无RNase的水或0.5℅SDS,用枪头吸打几次,55~60℃放置10分钟使RNA溶解。如RNA用于酶切反应,勿使用SDS溶液。RNA也可用100℅的去离子甲酰胺溶解,-70℃保存。
预防RNase污染注意事项:
1.经常更换新手套,皮肤上常带有的细菌,霉菌可能成为RNase的来源。
2.使用灭过菌的RNA专用塑料制品避免交叉污染。
3.RNA在TRIzol试剂中时不会被RNase污染,但提取后继续处理过程中应使用不含RNase的塑料和玻璃器皿。玻璃器皿可在150℃烘烤4小时,塑料制品可在0.5M NaOH中浸泡10分钟,然后用水彻底清洗,高压灭菌,即可去除RNase。
4.配制溶液应使用无RNase的水(将水加入处理过不含RNase的玻璃瓶中,加入DEPC至终浓度0.01℅v/v,放置过夜,高压灭菌。注:DEPC有致癌之嫌,需小心操作)。
注意事项:
1.从少量样品(1~10mg组织或102~104细胞)中提取RNA时可加入少许糖原以促进RNA沉淀。例如加800mlTRIzol匀浆样品,沉淀RNA前加5~10μgRNase-free糖原。糖原会与RNA一同沉淀出来,糖原浓度不高于4mg/ml是不影响第一链的合成,也不影响PCR反应。
2.匀浆后加氯仿之前样品可以在-60至-70℃保存至少一个月。RNA沉淀可以保存于75% 酒精中2~8℃一星期以上或-5至-20℃一年以上。
3.分层和RNA沉淀时也可使用台式离心机,2600×g离心30~60分钟。
预期产量:1mg组织或1×106细胞提取RNA分别为:
肝和脾6~10μg ,肾3~4μg ,骨骼肌和脑组织1~1.5μg ,胎盘1~4μg ,上皮细胞8~15μg ,成纤维细胞5~7μg 。
常见问题分析:
得率低:
A.样品裂解或匀浆处理不彻底。
B.RNA沉淀未完全溶解。
A260/A280<1.65 :
A.检测吸光度时,RNA样品没有溶于水,而溶于了TE中。低离子浓度和低pH值条件下A280值偏高。
B.样品匀浆时加的试剂量太少。
C.匀浆样品时未在室温放置5分钟。
D.吸取水相时混入了有机相。
E.RNA沉淀未完全溶解。
RNA降解:
A.组织取出后没有马上处理或冷冻。
B.待提取RNA的样品没有保存于-60至-70℃,而保存在了-5至-20℃。
C.细胞在用胰酶处理时过度。
D.溶液或离心管未经RNase去除处理。
E.电泳时使用的甲醛pH值低于了3.5 。
DNA污染:
A. 样品匀浆时加的试剂量太少。
B.样品中含有有机溶剂(如乙醇,DMSO等),强缓冲液或碱性溶液。
蛋白聚糖和多糖污染:
沉淀RNA的过程中作以下改进可去除这些污染,步骤7中,每使用1ml TRIzol在水相中加0.25ml异丙醇和0.25ml高盐溶液(0.8M柠檬酸钠和1.2MNaCl)混合离心,按之前操作进行。这种方法可使蛋白聚糖和多糖留在溶液中,高效沉淀出纯RNA。从含有大量多糖的植物中提取RNA时应在匀浆后离心,并加上以上操作步骤。