深圳先进院纳米免疫光动力治疗肿瘤研究取得系列进展
近日,中国科学院深圳先进技术研究院研究员蔡林涛领衔的纳米医学研究组构建了肿瘤靶向供氧体系(杂交蛋白靶向纳米氧载体)和肿瘤原位产氧体系(二氧化锰纳米金笼)来增强光动力治疗效果,并引发肿瘤免疫原性细胞死亡(ICD),有效消除原位瘤和抑制远端瘤。相关成果分别发表在ACS Nano(2018,10.1021/acsnano.8b04371)和Biomaterials(2018,177:149-160)上。
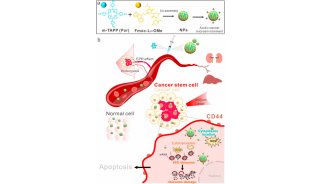
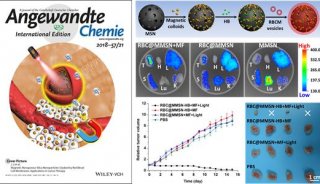
手术、化疗和放疗是临床肿瘤治疗的“三大板斧”,但是,肿瘤一旦发生转移,现有的治疗手段都具有局限性。因此理想的肿瘤治疗策略不仅能够高效、安全地根除原位肿瘤,而且还能通过激活机体免疫系统来识别和清除残留的肿瘤细胞,防止肿瘤转移和复发。蔡林涛团队成员陈志宽、梁锐晶、刘兰兰、郑明彬等在前期肿瘤靶向增氧干预治疗的研究基础(ACS Nano,2014,8,12310;Adv. Funct. Mater.,2017,27:1703197;Theranostics,2018,8:3584-3596)上,利用杂交靶向蛋白(白蛋白)和载氧蛋白(血红蛋白)包裹光敏剂(二氢卟酚e6,Ce6),制备了具有自供氧增强光动力治疗功能的杂交蛋白靶向纳米氧载体;另外,通过模板法构建了具有肿瘤原位增氧增强光动力效果的核壳型二氧化锰纳米金笼。
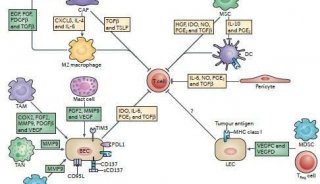
研究结果表明,利用杂交蛋白氧载体的肿瘤靶向供氧方式,或者二氧化锰纳米金笼特有的肿瘤微环境(低pH/富含过氧化氢)响应原位产氧方式,均能有效改善肿瘤缺氧微环境,并在激光照射下,显著提升瘤内单线态氧的产生,强有力地诱导原位瘤“免疫原性细胞死亡”(Immunogenic Cell Death,ICD)。ICD会增强免疫原性信号分子如钙网蛋白(CRT)、高迁移率族蛋白B1(HMGB1)和三磷酸腺苷(ATP)等的释放,促进树突状细胞成熟,进而增加肿瘤内活化的效应细胞(CD8+ T细胞、CD4+ T细胞、NK细胞)的数量,产生抗肿瘤免疫效应,从而有效抑制远端瘤和转移瘤,突破局部光动力治疗难以抑制转移肿瘤的瓶颈。
该项目获得国家自然科学基金、科技部国际合作、广东省自然科学基金研究团队、广东省纳米医药重点实验室、深圳市科创委基础研究项目和中国博士后科学基金等的资助。