Q Exactive中TMT定量工作流程的参数优化和Proteome Di...(一)
Q Exactive中TMT定量工作流程的参数优化和Proteome Discoverer2.1数据处理方法
Xiaoyue Jiang1, Tabiwang Arrey2, Eugen Damoc2, Michaela Scigelova2, David Horn1, Rosa Viner1, and Andreas F.R. Huhmer1
1Thermo Fisher Scientic, San Jose, CA, USA; 2Thermo Fisher Scientic, Bremen, Germany
关键词
Q Exactive Plus,Q Exactive HF,TMT,Proteome Discoverer 2.1,蛋白质鉴定,相对定量,同量异序标签,多重定量
研究目标
在 Thermo ScientificTM Q
ExactiveTM 仪器平台上,采用 Thermo ScientificTM TMTsixplexTM 和 TMT10plexTM
工作流程,建立最优的质谱数据采集方法将其应用于蛋白质的相对定量研究中。本文详细介绍了该工作流程所涉及的样品前处理、肽段分离和质谱分析等过程,以及采用
Thermo ScientificTM Proteome DiscovererTM 软件 2.1 版本对数据进行处理和分析的具体流程。
背景介绍
同量异序标签(如 Tandem Mass 标签TM
(TMTTM)1 或 isobaric Tag for Relative and Absolute
Quantification(iTRAQ®)2)是基于质谱技术的蛋白质相对定量方法中非常常见的一种。3-6 其中,基于 TMT
标签的多重相对定量方法具有很多优势,包括整个实验周期更短、波动更小,样品通量更高,以及样品间定量数据的缺失更少等。标记氨基的 TMT10plex
与 TMTsixplex 反应试剂的化学结构相同但是前者在质量报告区域中可以提供更多的 13C 和 15N
同位素组合形式。对于某些组合间彼此仅相差一个中子的质量,需要高分辨率的分析仪器实现串联质谱谱图采集才能进行区分。
Thermo ScientificTM TribridTM 质谱仪家族,包括 OrbitrapTM FusionTM MS 和 Orbitrap Fusion LumosTM MS 仪器,所提供的同步母离子选择(SPS)MS3 方法能够在具有高动态范围的复杂样品中实现最为准确的 TMT 定量分析。7,8 而 Thermo ScientificTM Q ExactiveTM 质谱仪系列仪器,结合了四极杆对母离子选择的高选择性和高特异性与 Orbitrap 质量分析器的高分辨率和准确质量(HRAM)检测能力的优势,也是进行同量异序定量分析的一把好手。Thermo ScientificTM Q ExactiveTM Plus 质谱仪通过配备改进的四极杆技术(AQT)以优化离子选择能力和传输效果,同时提高了在窄小的隔离窗口内对低丰度离子进行定量分析的能力。9 Thermo ScientificTM Q ExactiveTM HF 质谱仪引入了超高场 Orbitrap 质量分析器,能够以两倍于 Q Exactive Plus MS 的扫描速度实现高分辨率检测,表现出了更为优异的性能。9
基于 Q Exactive 质谱仪的 TMT 标记定量分析流程,不仅能够实现肽段和蛋白质鉴定结果的最大化,而且能够同时为多达十个不同样品提供高定量准确度的相对定量结果。该流程的前提是需要良好的色谱分离效果、充分分辨的质谱峰、足够的离子丰度,以及能以高扫描速度采集高质量的 MS2 碎裂谱图。本应用文档为 TMT 标记及其相对定量策略提供了详细的分步指导,包含样品前处理、仪器设置,以及采用 Thermo ScientificTM Proteome DiscovererTM 2.1 软件对多重定量数据进行处理和分析。本文详细讨论了关键仪器参数(分辨能力、最大注入时间、自动增益目标值、碰撞能量和隔离窗口等)对蛋白质和肽段鉴定以及定量结果的影响,以保证用户能够参照本文成功地在 Q Exactive 系列质谱仪上建立 TMT 定量工作流程。
实验方法
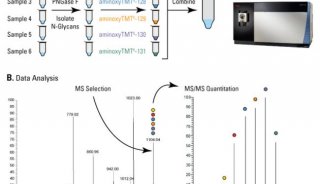
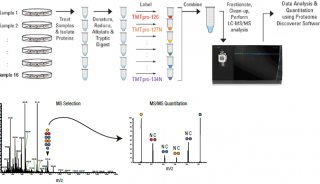
TMT 标记
采用 Thermo Scientific TMT 试剂对 E. coli 酶解产物标准样品(Waters® Corp,Milford,MA)按如下步骤进行标记:
1. 将三乙胺碳酸盐 (TEAB) 缓冲液、TMT 标签和干粉状态下的样品从 -20 ℃ 转移至室温下平衡。
2. 将 500 μL 溶解缓冲液 (Dissolution Buffer,1 M TEAB) 加入到 4.5 mL 超纯水中,制备 100 mM TEAB 溶液。
3. 将单个样品(不超过 100 μg/TMT 标签) 溶于 100 mM TEAB 缓冲液,得到 1 μg/uL 的样品溶液,充分涡旋振荡,放置 10 分钟。
4. 在每个 TMT 试剂瓶中加入 41 μL 新鲜 LC-MS 级乙腈,充分涡旋振荡,放置 10 分钟。
5. 在每个 TMT 试剂瓶中加入不高于 100 μL 第 3 步中制备的样品溶液,涡旋振荡,孵育 1 小时。
6. 反应 1 小时后,向每个小瓶中加入 8 μL 5% 羟胺(将试剂盒中提供的 50% 羟胺储备液用水稀释 10 倍)以终止反应,孵育 15 分钟。
7.标记结束后,立即按所需比例混合不同样品。在本研究中,TMTsixplex
试剂(通道 126-131)的混合比例为 20:10:1:1:10:20。所选六种 TMT10plex 试剂(通道
127C,128N,128C,129N,129C,130N)以相同比例混合。
8. 将制备好的样品分成小份,干燥,在 -80 ℃ 下储存。
9. 进行 LC-MS 分析前将制备好的 TMT-标记样品重悬于 0.1% TFA/5% ACN (v:v)溶剂中;重悬好的 TMT-标记样品能够在 4 ℃ 稳定保存一周,避免反复冻融。
为考察定量分析的准确度,将
Thermo ScientificTM PierceTM HeLa 蛋白酶解产物标准样品(P/N 88328)按上述流程进行标记,将
TMTsixplex 通道 129–131 和 TMT10plex 通道 127N、127C 和 128N 分别以 10:10:10
比例混合,然后加入 E. coli 样品中,每通道比例为 1:1(33 μg HeLa 酶解产物 + 67 μg E. coli 酶解产物)。
液相色谱
色谱分离条件设置详见表 1。进样量相当于 1 μg 起始蛋白质。
参数 | 设置 |
LC | Thermo ScientificTM EASY-nLCTM 1000 |
流动相 | A:0.1% 甲酸水溶液;B:0.1 % 甲酸乙腈溶液(Fisher Chemical) |
洗脱梯度 | 0-100 min 7–25% B;100-120 min 25–60% B;121 min 95% B,保持 95% 5 min |
流速 | 300 nL/min |
捕集柱 | Thermo ScientificTM AcclaimTM PepMapTM 100 C18 LC 柱,75 μm x 2 cm,Thermo ScientificTM DionexTM nanoViperTM,C18,3 μm,100 Å(P/N 164705) |
分离柱 | Thermo ScientificTM EASY-SprayTM C18 LC 柱,75 μm x 50 cm,2 μm,100 Å(P/N ES803) |
质谱仪
通过液相色谱洗脱得到的肽段分别由 Q Exactive Plus 和 Q Exactive HF 质谱仪在数据依赖采集模式下进行分析。仪器参数设置参见表 2。
表 2. 采用 Q Exactive Plus 和 Q Exactive HF 仪器分析 TMTsixplex 和 TMT10plex 标记样品的推荐仪器参数设置
Q Exactive Plus | Q Exactive HF | |
全扫 MS 参数 | ||
分辨能力 (m/z 200 处的 FWHM) | 70,000 | 120,000 |
自动增益目标值(AGC) | 3e6 | 3e6 |
最大注入时间 (ms) | 50 | 50 |
扫描范围 (m/z) | 375-1400 | 375-1400 |
MS2 参数 | ||
分辨能力 (m/z 200 处的 FWHM) | 35,000 | 30,000 (TMTsixplex) 60,000 (TMT10plex) |
自动增益目标值(AGC) | 1e5 | 1e5 |
最大注入时间 (ms) | 100 | 100 |
隔离窗口(Th) | 0.7 或 1.2 | 0.7 或 1.2 |
归一碰撞能量 (NCE) | 32 | 32 |
环数(Loop count) | 10 或 15 | 10 或 15 |
起始质荷比(First fixed mass) | 100 | 100 |
最小填充比(Underfill ratio) | 2% | 2% |
电荷数识别(Charge state recognition) | 2-7 | 2-7 |
肽段匹配(Peptide match) | 优选 | 优选 |
动态排除(Dynamic exclusion(s)) | 30 | 30 |