罗氏单抗药Gazyva获FDA批准用于CLL
罗氏(Roche)11月1日宣布,单抗药物Gazyva(obinutuzumab,又名GA101)获FDA批准,联合苯丁酸氮芥(chlorambucil)化疗,用于既往未经治疗的慢性淋巴细胞白血病(CLL)患者。
Gazyva是罗氏在过去3年中获FDA批准的第5个抗癌药物,该药的获批,将减少生物仿制药对罗氏重磅药物美罗华(Rituxan,通用名:rituximab,利妥昔单抗)的冲击。
此前,FDA已授予Gazyva突破性疗法认定(Breakthrough Therapy Designation)及优先审查资格(Priority Review),旨在加快药物的开发及审批。
Gazyva的获批,是基于III期CLL11试验的结果。该项研究表明,与苯丁酸氮芥化疗组相比,Gazyva联合苯丁酸氮芥化疗治疗组患者病情进展或死亡风险降低84%(HR=0.16,p<0.0001),同时疾病无进展生存期显着延长(PFS=23.0个月 vs 11.1个月)。
今年7月,罗氏公布了CLL11研究的积极数据,在一项既定的中期分析中,一个独立数据监控委员会发现,该项研究达到了主要终点:在既往未经治疗的慢性淋巴细胞白血病(CLL)患者中,与美罗华(Rituxan)+化疗药物苯丁酸氮芥(chlorambucil)相比,GA101+苯丁酸氮芥显着延长了疾病无进展生存期(PFS)。CLL11研究目前正由基因泰克与德国白血病研究组(GCLLSG)合作开展,最终数据将提交至2013年12月举行的美国血液学学会第55届年会。
GA101是首个糖基化的II型抗CD20单克隆抗体,这意味着GA101中的特定糖分子能够被修改,来改变其与人体免疫细胞的相互作用。这种修饰作用,创造了一种独特的抗体,旨在作为一种免疫疗法,利用患者自身的免疫系统来帮助攻击癌细胞。此外,GA101与CD20的结合,能够直接诱导细胞死亡。
GA101旨在增强抗体依赖性细胞毒性作用(Antibody-Dependent Cellular Cytotoxicity,ADCC)及直接的细胞死亡诱导作用(Direct Cell Death induction)。
GA101由罗氏旗下全资子公司GlyArt AG利用其专有的抗体修饰技术GlycoMAb技术开发,该药与美罗华均选择性靶向B细胞上的CD20蛋白,目前rituximab已获日本及海外推荐列入非霍奇金淋巴瘤的治疗指南。
美罗华(Rituxan)是一种嵌合鼠/人单克隆抗体,是全球第一个被批准用于临床治疗非霍奇金淋巴瘤(NHL)的单克隆抗体,该药的欧洲专利将于2013年底到期。
今年4月,基于CLL11试验数据,罗氏已分别向FDA及EMA提交了GA101的上市许可申请(marketing application)。
CLL是最常见的血液癌症之一,预计2013年在美国有近5000人死于该病。CLL11研究的患者包括以前未经治疗的年老CLL患者,这些患者通常不能承受现有的积极治疗方案。
-
产品技术
-
财报
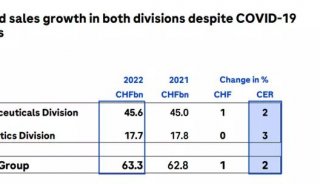
-
企业风采

-
焦点事件
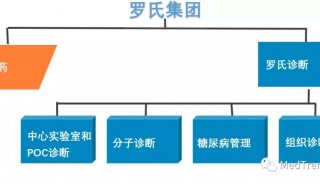
-
财报
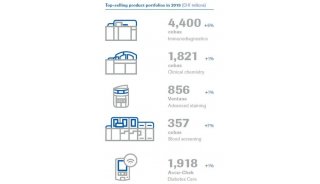
-
焦点事件