中科院PI发表Nature子刊文章:直击肿瘤微环境
肿瘤生长不仅取决于恶性肿瘤细胞的遗传改变,也取决于基质、血管、浸润炎症细胞等肿瘤微环境(TME,tumor microenvironment)的改变。不少研究表明肿瘤干细胞是肿瘤耐药、复发和转移的根源,因此深入研究肿瘤炎性微环境对肿瘤干细胞的调控机制,也许将有助于科学家们找到潜在的治疗靶点。
近期来自中科院上海巴斯德研究所,上海中医药大学等处的研究人员揭示了I型辅助性T细胞样的调节性T细胞(Th1-like Treg)在体内的发生机制,这对于打破肿瘤微环境中的免疫耐受具有潜在临床应用价值。
这一研究成果公布在11月18日的Nature Communications杂志上,文章的通讯作者是上海巴斯德研究所的李斌研究员,其研究组长期致力于研究人体免疫系统如何调节健康与疾病,包括病毒类传染性疾病,自身免疫性疾病和癌症发生的细胞及分子机理。文章第一作者为分子免疫学课题组博士研究生李扬扬和上海中医药大学药学院吕玥博士。
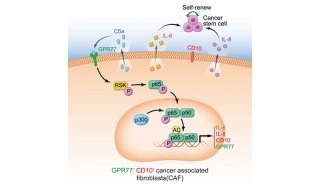
调节性T(Treg)细胞维持着体内免疫稳态,抑制过度激活的免疫反应。Treg细胞的稳定性与可塑性关系到多种免疫性疾病的发生和发展。其中,Treg细胞功能稳定性受到多种胞外信号调节,例如细菌脂多糖(LPS)、IL-1β和热激活(heat shock)等信号能诱导Treg细胞关键转录因子FOXP3蛋白的泛素化降解。但是,体内调控FOXP3+Treg细胞稳定性的机制目前尚不清楚。
在这篇文章中,研究人员利用Treg细胞中特异性敲除去泛素化酶Usp21基因的小鼠,发现小鼠肝脏、肺和唾液腺等器官中Usp21基因缺陷的Treg细胞分泌大量的炎症因子IFN-γ。同时体外分化实验也证实该细胞变得更像I型辅助性T(Th1)细胞。
研究人员进一步还发现,USP21通过去泛素化修饰来抑制关键转录因子FOXP3蛋白的降解,从而稳定Treg细胞。因此,在体内,FOXP3不稳定的Treg细胞具有分泌大量Th1型细胞因子的能力,并进一步诱发过度激活的后续Th1型免疫反应。
近期研究成果显示,结肠癌患者体内低表达FOXP3的Treg细胞分泌更多的炎性细胞因子IFN-γ,并预示结肠癌患者更好存活率。因此,针对去泛素化酶USP21的小分子抑制剂有可能会在肿瘤微环境中诱导产生更多的Th1-like Treg细胞,更有利于打破肿瘤微环境中的免疫耐受,增强抗肿瘤免疫反应。
一些科学家从不同的方面“围击”肿瘤微环境,来自伊利诺伊大学的一项研究发现在恶性肿瘤中,只有少数肿瘤细胞能够逃脱和扩散到身体的其他部位,但是,沿着肿瘤边缘的曲线,可能对于激活这些肿瘤种植细胞,起到了很大的作用。
研究人员在他们的工程环境中做了大量的测试,以确认肿瘤传播能力,比如遗传分析。他们还测试了其他癌细胞系——人类宫颈癌、肺癌和前列腺癌,并发现它们以同样的方式对有图案的肿瘤环境做出了反应。
-
项目成果
-
项目成果