日本公司肝癌新药 3期临床结果积极
日本卫材公司(Eisai)近日宣布,该公司研发的抗癌药物甲磺酸乐伐替尼(lenvatinib,商品名Lenvima,Kisplyx)在肝细胞癌(HCC)患者中的3期临床研究REFLECT结果积极,已发表在知名医学期刊《柳叶刀》上。
肝癌是致死率第二的癌症,估计全球每年有75万人因此死亡,且每年新诊断病例为78万。这种疾病的地区差异很大,约80%的新病例发生在亚洲地区,包括中国和日本。HCC占肝癌的85%至90%。目前,批准用于HCC一线疗法的全身治疗非常有限。
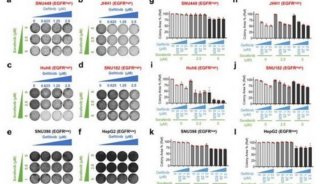
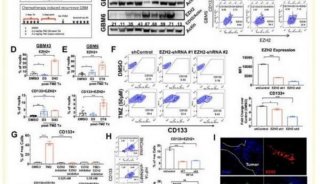
乐伐替尼是一种口服性的受体酪氨酸激酶(RTK)抑制剂,具有新的结合模式,可选择性抑制VEGFR家族(VEGFR1、VEGFR2、VEGFR3)以及FGFR家族(FGFR1、FGFR2、FGFR3、FGFR4)的激酶活性。它也能抑制与肿瘤增殖有关的RTK(包括PDGFRα,KIT,和RET)活性。
REFLECT是一项全球多中心、随机、开放标签的3期临床研究,比较了在晚期HCC患者中,乐伐替尼与标准疗法索拉非尼(sorafenib)的有效性和安全性。在研究中,954名患者以1:1的比例随机分组,每天一次接受12毫克(如果体重超过60公斤)或8毫克(如果体重低于60公斤)的乐伐替尼(n = 478),或每天两次接受400毫克的索拉非尼(n = 476)。研究的主要终点是总生存期(OS),目标是证明乐伐替尼的非劣效性。其他次要终点包括无进展生存期(PFS),肿瘤进展时间(TTP),客观缓解率(ORR)和生活质量(QOL)。在这项研究中,乐伐替尼显示了在OS这个主要终点上的疗效。此外,乐伐替尼在PFS,TTP和ORR上也显示出统计学意义的显著提高和具有临床意义的改善。
该论文还报道了基于盲法独立影像审查(IIR)的次要终点探索性分析结果。IIR审查基于实体瘤疗效评价标准RECIST1.1(使用传统的肿瘤直径变化评价方法)以及修正RECIST评估方案(mRECIST),其中mRECIST除了1.1版的标准外,还考查了肿瘤坏死的面积。IIR审查结果同样证实了研究结论。