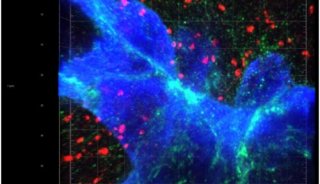
Nature:癌症百年谜题终遭破解 有望带来乳腺癌全新疗法
大约在100年前,著名的生理学家Otto Warburg教授与他的同事们发现了癌细胞一个有趣的现象:和正常细胞相比,癌细胞要消耗更多的葡萄糖。这听起来很合理——癌细胞是一类需要快速分裂和增殖的恶性细胞,当然需要更多的能量。
可是对这些癌细胞的进一步分析,却催生了一个巨大的谜题:我们知道细胞主要有两种代谢葡萄糖的方式,一种是通过线粒体的有氧呼吸,另一种则是发酵(无氧途径的一种)。前者产生能量(ATP)的效率要远高于后者。但令人意外的是,将近80%的癌细胞会使用发酵来获取能量。为什么癌细胞不用效率更高的代谢方式呢?这个被称为“Warburg效应”的问题深深困扰了百年来的癌症科学家们。
来自著名癌症研究机构贝勒医学院(Baylor College of Medicine)的一支团队意外地发现了这个问题的答案。这项研究的主要负责人之一Bert O'Malley教授曾在多年前与团队一道发现了一种叫做SRC-3的转录调控蛋白。这类蛋白在大部分癌细胞里会过量表达,而它会进一步“启动”引起异常生长、癌症转移、乃至癌症耐药的基因,可以说是部分癌症的一大罪魁祸首。
研究人员们也发现,癌细胞往往会“改造”SRC-3蛋白。比如,如果在SRC-3蛋白上加上一个磷酸基团,这个蛋白的活性就会大大增加,诱导肿瘤产生。这个磷酸基团又会进一步提高SRC-3的转录水平,形成恶性循环……
那么,细胞里的哪些“共犯”会提高SRC-3的活性呢?研究人员们通过筛选,发现一种叫做PFKFB4的蛋白起到了主要的调控作用。这让研究人员大为意外。
“这完全出乎我们的预料,”该研究的第一作者Subhamoy Dasgupta博士说道:“我们只知道PFKFB4能给Warburg通路里的糖分子添加磷酸基团。没有人想到它居然还能给蛋白质添加磷酸基团!”
更令人激动的发现还在后头!研究人员们意识到,PFKFB4可能通过给SRC-3添加上磷酸基团,让后者变成一个癌症驱动蛋白。换句话说,如果我们能消除或抑制PFKFB4,就有望“关闭”潜在的致癌变化。在小鼠模型中,这一假设得到了验证。研究人员们发现,如果移除肿瘤里的PFKFB4或SRC-3,就几乎能彻底消除乳腺癌的复发和转移。此外,抑制SRC-3的磷酸化也能起到同样的效果。这些研究表明PFKFB4介导的SRC-3磷酸化的确是诱发癌症的关键,也为未来的癌症疗法开发提供了两个潜在靶点。
这个今日在线发表在顶尖学术期刊《自然》上的研究回答了百年来困扰肿瘤学家的难题。“癌细胞明明需要大量的能量来维持生长,为什么它们还倾向使用产生ATP较少的通路?Warburg通路对癌细胞来说难道能带来什么优势吗?我们的研究吹散了这些谜团。” O'Malley教授说道。
原来,癌细胞早就做出了选择。诚然,他们选择的代谢通路产生能量的效果不高,但却能极大地帮助它们扩散与转移。很不幸,狡诈的癌细胞选择的道路对癌症扩散是有利的。
但一旦识破癌细胞的策略,我们就有望带来新的抗癌方法。“这项研究的有趣之处在于我们解决了这个百年来的谜题。我们的发现也能带来更多未来疗法的靶点。考虑到乳腺癌的复发与转移是临床上的一大挑战,这些潜在新疗法非常重要。” O'Malley教授补充道。
-
科技前沿
-
科技前沿

-
科技前沿

-
项目成果
-
科技前沿
-
焦点事件
-
项目成果