《中国药典》2020年版四部通则增修订概况与亮点
北京市药品检验所楼舸带来题为“《中国药典》2020年版四部通增修订情况的研究 ”的精彩报告,其中介绍了《中国药典》2020年版四部通则增修订概况与亮点。
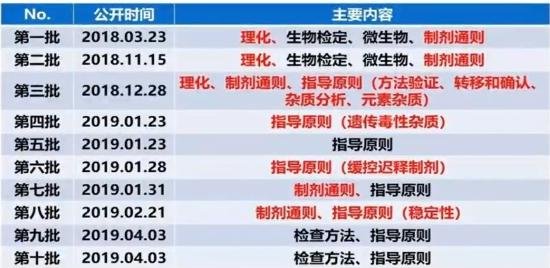
2018年3月23日起,国家药典委就开始公布《中国药典》2020年版四部通则的修订意见稿,共10批。从表中可见,《中国药典》2020年版四部的增修订内容相比历届药典,变化巨大,可以从以下几个方面概括。
(一)整体提升对药品质量的控制水平
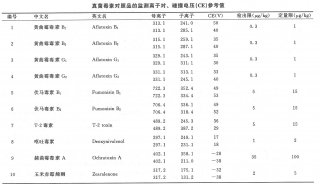
本次修订了片剂、注射剂、胶囊剂等35个制剂通则;新增中药饮片微生物限度检查法、真菌毒素测定法等通则方法8个、修订了25个;新增元素杂质限度和测定指导原则、遗传毒性杂质控制指导原则等指导原则10个、修订8个。
(二)制剂通则相关要求更加完善
1、以保证临床安全性和有效性为导向,以提高制剂的稳定性和批间一致性为目的,缩小同品种不同企业间产品的质量差异,进一步完善和提高制剂通则的要求。将药用辅料功能性评价要求与完善制剂通则相结合。
2、增加国内上市药品成熟的新剂型的收载,及时将我国制药的最新成果体现在药典标准中,体现《中国药典》的先进性。
3、建立和完善药品制剂全过程质量控制要求,保证制剂生产的规范性,确保药品生产过程可控、质量可靠。
4、加强制剂通则对药品安全性、有效性的控制要求。在安全性控制方面,可参照国际先进检测技术和检测限度,相关控制项目和限度指标应与国际先进标准保持一致。
5、根据我国药品生产状况以及存在的潜在风险,研究制定和建立相应的质控项目,以保证药品制剂的工艺合理和生产规范,最终提高临床使用的安全性和有效性。同时,提高制剂的稳定性,淘汰不合理剂型。
(三)加强安全性控制要求和限度标准的制定
完善高风险制剂质控要求,加强安全性质控要求和限度标准的制定,如0111吸入制剂,拟将吸入喷雾剂和供雾化器用的液体制剂列为无菌制剂。犹如增订了元素杂质限度和制定指导原则,将极大提高姚平仲元素杂质的检出能力,对于患者来说是极大的利好;对于生产企业来说,将面临一次广泛的生产工艺、分析方法和仪器设备的产业升级。
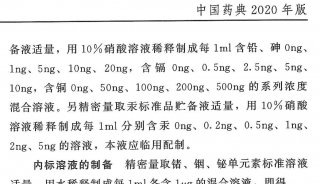
如:新增元素杂质限度和测定指导原则:建立辅料或物料的元素杂质标准限度,建立原料药的元素杂质标准限度,建立制剂的元素杂质标准限度。
(四)加强药品有效性控制检测方法的建立
例如:如溶出度测定是药品全生命周期中不同阶段质量控制使用的最有效方法之一,一致性评价品种中约有75%以上的品种采用溶出度法用于质量控制,新版药典增订了溶出度测定流池法(ICH Q4 Annex 7)及往复筒法。
影响溶出度实验结果的因素主要有3个:
1、溶出度仪本身的物理参数因素,如温度、转速、桨叶、网篮的高度及其底端抖晃度,转杆与溶出杯的中心度、垂直度等。
2、相关环境因素,如仪器的工作环境、噪声、震动等。
3、操作人员的熟练程度和准确度。
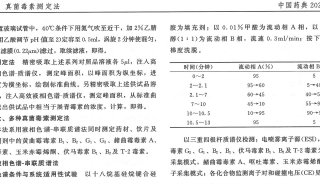
为提升溶出性能,国家食药监局2016年出台了药物溶出度仪机械验证指导原则,共有9项验证参数,包括溶出度仪水平度、篮(浆)轴垂直度、溶出杯垂直度、溶出杯与篮(浆)轴同轴度、篮(浆)轴摆动、篮(浆)深度、篮(浆)轴转速、溶出杯内温度。这也导致了药物溶出度仪机械验证是药厂必须要做的工作,也随之产生了相关的专用仪器和验证方法。例如溶出度仪机械验证工具包等测量器具,标准促进了仪器的校正、验证和方法工具的提高。
而随着仿制药一致性评价药品剂型增加,方法扩展,迫切需要引入其他类型的溶出度仪。因此,《中国药典》2020年版增加了流通池法溶出度仪、往复筒法/往复架法溶出度仪方法,这两种是美国药典中已经收载的方法。这对国内外的仪器厂家和相关的第三方检测机构来说也使一个巨大的商机。
(五)全面完善检验方法验证、数据分析统计
新版药典修订了分析方法验证指导原则,增订了分析方法确认指导原则、分析方法转移指导原则、药品检测结果不确定度评定指导原则,以期为药品检验工作者和质量控制人员提供指导性强、可具体操作的技术性参考。
例如:分析方法确认指导原则
分析方法确认是指首次使用法定分析方法时,由现有的分析人员对分析方法中关键的验证指标进行有选择性的考察,以证明方法对所分析样品的适用性,同时证明分析人员有能力使用该法定分析方法。《分析方法验证指导原则》中提供了建立分析方法需要验证的指标,分析方法的确认并不是重复验证过程。(确认过程+转移要素)
(六)理化分析通则的修订和创新
理化分析检测是药品质量分析和控制的重要技术基础,2020版对理化分析通则进行15项修订。
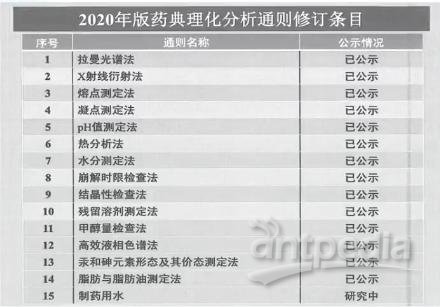
比如:拉曼光谱法、pH值测定法、粉末X射线衍射法、高效液相色谱法、热分析法等。
拉曼光谱法中增加了具体应用内容,并对拉曼光谱法的分类细化,增加了具体实验要求。
而其中对高效液相色谱法的修订内容有很多,包括规定了检测器。高效液相色谱法是药检中的主要武器,其中修订的内容很多。增加了电喷雾法、增加了多维液相描述等。对测定法,补充了定性分析,而原有的测定方法则改为定量方法。对色谱柱、填料粒径和设定参数都进行了详细的规定范围。
热分析法中,热重中增加与质谱联用的内容,在差热法中差式扫描中,对参比物描述进行修改。
(七)建立药品全过程质量控制体系
进一步强化药品质量全过程控制理念,加强涉及药品研发、生产、过程控制、质量评价、运输、包装、贮藏、有效性、稳定性及生产检验环境的相关技术指南的制定,丰富了药品标准的内涵,对全面提升药品质量意义重大。如在指导研发阶段,修订了缓释、控释和迟释制剂指导原则,增订了注射剂过程控制指导原则;在检验环境控制阶段,修订了无菌检查用隔离系统验证和应用指导原则等等。
(八)药品质控技术与方法与国际接轨
我国药品监管部门正式成为人用药物注册技术要求国际协调会(ICH)成员以后,中国药品标准逐步与国际标准接轨已经成为必然趋势。
新版药典充分借鉴国外药典经验,加强现金成熟检测技术的应用,如增修订X射线荧光光谱法(XRF)、相对密度测定法——震荡性密度计法、堆密度与振实密度测定法等。