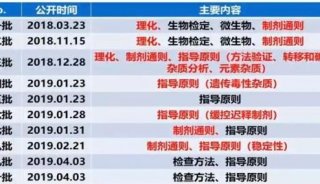
药物稳定性试验之2020中国药典9001指导原则修订解读
在稳定性试验基本要求部分就有了比较大的修订。
1、影响因素试验用 1 批原料药物或 1 批制剂进行;如果试验结果不明确,则应加试 2 个批次样品。生物制品应直接使用 3 个批次。
这就要求待试样品储备需要充足,批次要求多了,尤其是生物制品,直接需要备齐三个批次。
2、药物制剂如片剂、胶囊剂,每批放大试验的规模,至少是中试规模批次。批次规模也上升到中试规模。
3、【删除】供试品的质量标准应与临床前研究及临床试验和规模生产所使用的供试品质量标准一致。
质量标准的统一性不言而喻,且与稳定性试验关联性不强。
4、【增加】一个基本要求:(6)对包装在有通透性容器内的药物制剂应考虑药物的湿敏感性或可能的溶剂损失。
由于PE、PP、PVC、非PVC共挤膜制袋等这些半通透性容器可能会与外界发生水气交换,导致容器内药液体积减少及浓度升高,这属于安全风险因素,需要在低湿条件下考察验证包装对药品的保护能力。
5、【增加】制剂质量的“显著变化”通常定义为:①含量与初始值相差5%,或生物或免疫法测定时效价不符合规定;②任何降解产物超过标准限度要求;③外观、物理常数、功能试验(如颜色、相分离、再分散性、粘结、硬度、每揿剂量等)不符合标准要求;④pH 值不符合规定;⑤12个制剂单位的溶出度不符合标准的规定。
与ICHQ系列规范接轨,有效界定了“显著变化”的内涵与外延,减少理解偏差与误解误用。
一、原料药物
(一)影响因素试验
6、摊成≤5mm 厚的薄层,疏松原料药物摊成≤10mm 厚的薄层, 进行以下试验分散放置,厚度不超过3mm(疏松原料药厚度可略高些)
影响因素试验虽然并非强制降解试验,没有降解比例要求,但依然需要构造相对苛刻的实验场景,将待试样品分散摊薄,与影响因素进行充分接触。
7、高温试验,供试品开口置适宜的洁净容器恒温设备中,高温试验一般高于加速试验温度 10℃以上, 考察时间点应基于原料药本身的稳定性及影响因素试验条件下稳定性的变化趋势设置。通常可设定为0天、5天、10天、30天等。若供试品质量有明显变化,则适当降低温度试验。
温度是影响药物质量的一个很重要的影响因素,而高温又首当其冲,随着温度升高,降解风险在增大,考察周期拉长到一个月,有利于收集更为充分的数据;同时明显变化后的再测试温度条件,并没有局限在原先的40℃,将试验条件选择权交予试验者也是很务实可行的。
8、强光照射试验供试品开口放在装有日光灯的光照箱或其他适宜的光照装置内,光源可选择任何输出相似于 D65/ID65 发射标准的光源,或同时暴露于冷白荧光灯和近紫外灯下,并于照度为 4500Lx± 500Lx 的条件下,且光源总照度应不低于 1.2×106lux· hr,近紫外灯能量不低于 200W· hr/m2,于适宜时间取样。
这是与ICHQ接轨的表现,转化吸收了ICHQ1B的关键参数要求,只是没有遵循ICHQ1B的化学荧光辐照测定法,仍然保留了物理测量法中的瞬时照度指标要求,使得测试周期不至于过短。
9、关于光照装置,建议采用定型设备“可调光照箱”,也可用光橱,在箱中安装日光灯数相应光源使达到规定照度。
随着技术的发展,日光灯已经不再是唯一可选光源,只要符合光照度要求均可尝试。
10、此外,根据药物的性质必要时可设计试验:原料药在溶液或混悬液状态时,或在较宽 pH 值范围探讨 pH 值与氧及其他条件应考察对药物稳定性的影响,并研究分解产物的分析方法。创新药物应对分解产物的性质进行必要的分析。冷冻保存的原料药物,应验证其在多次反复冻融条件下产品质量的变化情况。在加速或长期放置条件下已证明某些降解产物并不形成,则可不必再做专门检查。
除了重要的温湿度光照之外,还赋予试验者必要时进行其他影响因素考察试验的设计,同时针对冷冻保存的药物进行反复冻融试验,验证稳定性。
(二)加速试验
11、检测至少包括初始和末次的 3 个时间点(如 0、 3、 6 月),如在 25℃±2℃、相对湿度60%±5%条件下进行长期试验,当加速试验 6 个月中任何时间点的质量发生了显著变化,则应进行中间条件试验。中间条件为 30℃±2℃、相对湿度 65%±5%,建议的考察时间为 12 个月,应包括所有的考察项目,检测至少包括初始和末次的 4 个时间点(如 0、 6、 9、 12 月)。
重写了加速试验要求,减少一次取样,更具条理性,厘清了之前版本里中间条件试验与加速试验之间的混乱关系,明确了中间条件试验周期是重新计时12个月,这对试验设备的持续稳定运行提出了更高的要求。
12、对温度特别敏感的药物,预计只能在冰箱中(5℃±3℃)保存,此种药物的加速试验,可在温度 25℃±2℃、相对湿度 60%±5%的条件下进行,时间为6个月。
提高了相关试验要求,与ICH接轨,将可允许的湿度波动范围收紧至±5%RH,之前使用的稳定性试验箱是否适用需要进行风险管理评估分析,必要时重新验证。
13、【增加】对拟冷冻贮藏的药物,应对一批样品在5℃±3℃或 25℃±2℃下放置适当的时间进行试验,以了解短期偏离标签贮藏条件(如运输或搬运时)对药物的影响。
处于安全考虑,对于冷冻贮藏药物需要审慎处理,由于湿度影响可以忽略,则可用低温培养箱或关掉湿度控制的稳定性试验箱来作为试验平台。
(三)长期试验
14、供试品3批,市售包装,在温度 25℃±2℃,相对湿度60%±5%的条件下放置 12 个月。
提高了相关试验要求,与ICH接轨,将可允许的湿度波动范围收紧至±5%RH,之前使用的稳定性试验箱是否适用需要进行风险分析,必要时重新验证。
15、对温度特别敏感的药物,长期试验可在温度5℃± 3℃的条件下放置 12 个月
这算是本次修改中为数不多的放宽技术要求的项目,对于低温冰箱而言,要做温度空间均匀度考察,难度会随着体积增大通过挑战性也在增加,建议采用低温培养箱。
16、【增加】对拟冷冻贮藏的药物,长期试验可在温度-20℃±5℃的条件下至少放置 12个月。
与前述几项类似,继续与ICH接轨,部分转化了相关技术要求。
二、药物制剂
(一)影响因素试验
17、除去外包装, 并根据试验目的和产品特性考虑是否除去内包装
关于制剂包装的影响程度不一,需要根据具体情况酌情处理,必要时需要去除内包装。或进行对比预试验。
18、增加对于需冷冻保存的中间产物或药物制剂,应验证其在多次反复冻融条件下产品质量的变化情况。
与原料药物相同,也需要考虑冻融的影响,需要根据冻融试验条件配置相应的设备。
(二)加速试验
19、检测至少包括初始和末次的 3 个时间点(如 0、 3、 6 月),如在 25℃±2℃、相对湿度 60%±5%条件下进行长期试验,当加速试验 6 个月中任何时间点的质量发生了显著变化,则应进行中间条件试验。中间条件为 30℃±2℃、相对湿度 60%±5%,建议的考察时间为 12 个月,应包括所有的考察项目,检测至少包括初始和末次的 4 个时间点(如 0、 6、 9、 12 月)。
重写了加速试验要求,减少一次取样,更具条理性,厘清了之前版本里中间条件试验与加速试验之间的混乱关系,明确了中间条件试验周期是重新计时12个月,这对试验设备的持续稳定运行提出了更高的要求。
20、对温度特别敏感的药物制剂,预计只能在冰箱中(5℃±3℃)保存,此种药物的加速试验,可在温度25℃±2℃、相对湿度60%±5%的条件下进行,时间为 6 个月。
提高了相关试验要求,与ICH接轨,将可允许的湿度波动范围收紧至±5%RH,之前使用的稳定性试验箱是否适用需要进行风险管理评估分析,必要时重新验证。
21、增加 对拟冷冻贮藏的药物,应对一批样品在5℃±3℃或 25℃±2℃条件下放置适当的时间进行试验,以了解短期偏离标签贮藏条件(如运输或搬运时)对制剂的影响。
运输过程中的质量控制不可忽视,需要根据具体情况,酌情进行加速试验,时间长短由试验者依据科学依据确定。
(三)长期试验
22、供试品3批,市售包装,在温度25℃±2℃、相对湿度60%±5%的条件下放置 12 个月,或在温度 30℃±2℃、相对湿度 65%±5% 的条件下放置12个月
提高了相关试验要求,与ICH接轨,将可允许的湿度波动范围收紧至±5%RH,之前使用的稳定性试验箱是否适用需要进行风险管理评估分析,必要时重新验证。
23、对温度特别敏感的药品,长期试验可在温度 5℃±3℃的条件下放置 12 个月。
这算是本次修改中为数不多的放宽技术要求的项目。对于低温冰箱而言,要做温度空间均匀度考察,难度会随着体积增大通过挑战性也在增加,建议采用低温培养箱。
24、增加对拟冷冻贮藏的制剂,长期试验可在温度-20℃±5℃的条件下至少放置 12 个
月,货架期应根据长期试验放置条件下实际时间的数据而定。
这是与ICH接轨的表现,转化吸收了ICHQ1B的关键参数要求,只是仍然保留了瞬时照度的要求,使得测试周期不至于过短。
25、增加对于所有制剂,应充分考虑运输路线、交通工具、距离、时间、条件(温度、
湿度、振动情况等)、产品包装(外包装、内包装等)、产品放置和温度监控情况(监控器的数量、位置等)等对产品质量的影响。
制剂的稳定性受制于多种因素,需要充分考虑各种因素的影响,因此最后的制剂重点考察项目参考表有了较大幅度的扩充。

至此,9001稳定性试验技术指导原则梳理完毕,可以看出与ICH接轨是一个很明显的趋势,很多指标性参数均作了修订,也增加了一些试验种类或者考察项目,这些都对稳定性试验箱等试验平台提出了更高要求。接下来要做的并不是增购试验设备这么简单的工作。而是需要借助系统思维,启动风险管理程序,进行系统性风险评估,全方位考虑,必要时对稳定性试验箱重新验证,依据不符合要求结果进行稳定性试验箱的更换或添置。
此外,在P458页述及国际气候带的时候有一个长期试验条件的表述,“相对湿度为60%±10%”,这个10%应该是笔误,其余涉及60%RH的均为±5%RH,在以后的版本中应该会纠正。
-
仪器推荐
 询底价 Tel:400-6699-117 转 8440
询底价 Tel:400-6699-117 转 8440 -
仪器推荐

-
仪器推荐

-
仪器推荐

-
仪器推荐

-
焦点事件

-
标准
-
标准
-
会议会展