我国科学家发现gasdermin蛋白不依赖于蛋白酶裂解的激活机制
细胞焦亡(pyroptosis)是一种由gasdermin(GSDM)蛋白家族介导的程序性细胞死亡,在机体抵御病原体感染、清除异常或有害细胞等过程中发挥着重要作用。GSDM 是一类在进化过程中得到保护的孔形成蛋白,广泛分布于各种细菌、真菌、无脊椎动物和所有脊椎动物中。
GSDM 通常具有自我抑制的双结构域结构。蛋白水解裂解似乎是激活所有 GSDM 的普遍机制。除蛋白酶裂解外,GSDM 是否还有其他激活机制尚不清楚。
在一项新的研究中,中国科学院生物物理研究所丁璟珒(Ding Jingjin)研究员和中国北京生命科学研究所邵峰(Shao Feng)研究员领导的研究人员揭示了低等真核生物中两类 GSDM 蛋白不依赖于裂解激活的新机制。相关研究结果于2024年4月25日在线发表在Science期刊上,论文标题为“Cleavage-independent activation of ancient eukaryotic gasdermins and structural mechanisms”。
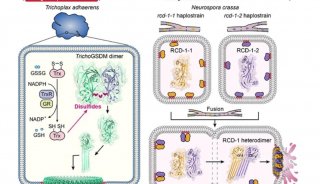
通过广泛的序列同源性分析,这些作者首次发现了基础后生动物丝盘虫(Trichoplax adhaerens)中的一种GSDM蛋白(下称TrichoGSDM),它只含有一个孔形成结构域。对纯化的 TrichoGSDM 进行表征后发现,这种 GSDM 蛋白以两种状态存在:单体和同源二聚体,其中只有单体形式具有在脂质体上形成孔的能力。
结构和生化分析表明,通过二硫键形成的同源二聚体代表了 TrichoGSDM 的自我抑制状态,它通过还原二硫键被激活为单体状态,从而进一步寡聚化并在细胞膜上形成孔,从而诱导类似于细胞焦亡的细胞死亡。在 TrichoGSDM 中发现的这种新型激活机制,在整个 GSDM蛋白家族中尚属首次。
此外,这些作者还重点研究了另一种仅有孔形成结构域的GSDM蛋白,即RCD-1,它是在丝状真菌粗糙脉孢菌(Neurospora crassa)中新发现的。RCD-1包含两种同源蛋白,即不同菌株中的RCD-1-1和RCD-1-2,它们控制着同种异体识别(allorecognition)诱导的真菌细胞死亡。
他们发现,膜结合的 RCD-1 蛋白在单独存在时处于非活性静止状态。然而,当不同菌株进行细胞融合时,两个 RCD-1 蛋白会相互相遇,并通过特定的分子间识别组装成异源二聚体,进一步在细胞膜上形成异源寡聚体孔,从而执行类似于细胞焦亡的细胞死亡。
图片来自Science, 2024, doi:10.1126/science.adm9190
在这项研究中,TrichoGSDM 和 RCD-1 代表了两类仅有孔形成结构域的 GSDM,它们来源于简单和古老的真核生物,使用不同的不依赖裂解的激活机制。
TrichoGSDM 是通过二硫键连接的自我抑制二聚体,通过二硫键的还原被激活,这表明它具有氧化还原反应功能。来自遗传上不相似的真菌菌株的RCD-1 和 RCD-1-2 之间的异源识别刺激了 RCD-1 中的孔形成活性,而这种异源识别是粗糙脉孢菌中诱导细胞死亡的基础。
这些多样化的激活机制表明,GSDM 蛋白可对多种生理信号做出反应,并参与多种生物过程。此外,这些仅有孔形成结构域的 GSDM 蛋白有可能被开发成不依赖于蛋白酶裂解的诱导细胞死亡的新型工具,从而促进与细胞焦亡相关的基础研究和转化研究。