知否?知否?驱动基因阳性的NSCLC脑转移患者该如何治疗?
肺癌是我国最常见的恶性肿瘤,颅脑是非小细胞肺癌(NSCLC)最常见的转移部位之一,首诊的NSCLC患者中约10%~15%伴有颅脑转移,30%~50%的NSCLC患者在整个病程中会发生颅脑转移,其中驱动基因阳性的肺癌患者脑转移发生率更高。
脑转移包括脑实质转移和软脑膜转移,NSCLC患者发生脑转移后其生活质量明显降低,自然生存期仅为1~2个月,传统的手术、立体定向放疗(SRS)和全脑放疗(WBRT)的生存期也只有3~6个月。
如何确诊NSCLC脑转移
目前有磁共振成像(MRI)、CT、PET/CT、组织和脑脊液细胞学及分子检测等多种方法用于肺癌脑转移的诊断。
1.活检
脑实质病灶经手术切除或活检明确而肯定的病理诊断是确立肺癌脑转移的金标准,但通过手术切除或切取部分病灶进行病理诊断具有复杂性、风险高、经济代价较高等缺点,因此,仅在需要通过手术切除病灶解除占位效应或高度怀疑脑占位是其他疾病的可能时,才建议手术切除或活检。
2.影像学检查
经病理诊断为NSCLC的患者,有或无脑转移的症状和体征,MRI和(或)CT提示脑内单发或多发病灶,排除其他情况,可以临床诊断肺癌脑实质转移。
MRI对微小脑实质转移病灶和脑膜转移病灶较CT(包括增强CT)更为敏感,尤其是位于后颅窝、颅底及颅顶等特殊部位的病灶,增强MRI在脑转移瘤的鉴别方面也最有优势,并能够进行肿瘤治疗效果评价等,因此目前认为增强MRI是发现脑实质转移病灶的首选影像检查。
存在MRI禁忌或无条件进行MRI检查时,推荐将增强CT作为替代检查手段。此外,CT扫描速度快,可用于出血、脑疝及脑积水等严重并发症的快速检查手段之一。
3.脑脊液脱落细胞学检查
NSCLC患者有或无软脑膜转移的症状和体征,脑脊液细胞学或脑脊液细胞块找到恶性肿瘤细胞,可确立肺癌软脑膜转移的诊断。
NSCLC患者具有软脑膜转移的症状和体征,同时MRI发现典型的软脑膜强化,排除感染等其他情况,即使脑脊液脱落细胞学阴性,仍可以临床诊断肺癌软脑膜转移。
研究发现,两次脑脊液肿瘤细胞的检出率由一次的55%上升到80%,但是更多次数重复并没有增加检出率;每次采集脑脊液的量从3.0mL增加至10.5mL时,恶性肿瘤细胞的阳性检出率也从68%提高至97%;脑脊液采集后30min,细胞存活率为50%,90min后只有10%的细胞存活。
因此建议为确定肺癌软脑膜转移的诊断,可进行多次脑脊液脱落细胞学或脑脊液细胞块病理检查,但以不超过3次为宜。每次抽取脑脊液的量不少于5.0mL,争取达到10.0mL。脑脊液标本需在30min内进行处理,最迟不得超过90min。
NSCLC脑转移的基因检测
肺腺癌的功能性驱动基因的突变率约为60%,其中EGFR突变、EML4-ALK融合最为常见。
鉴于酪氨酸激酶抑制剂相对分子质量小,脂溶性好,可明显改善脑内客观缓解率(ORR),显著延长NSCLC脑转移患者的无进展生存期(PFS)和总生存期(OS),因此建议诊断的同时进行EGFR、ALK基因检测,有条件可行ROS1、BRAF、HER2、RET及c-MET等基因检测。
驱动基因阳性的NSNCL脑转移的治疗
1.手术切除
对于颅外病灶控制良好、体能状态(PS)好的单发肺癌脑转移患者,推荐外科手术切除脑转移灶或针对脑转移灶进行SRS。
EORTC22952-26001研究显示,1~3次脑转移瘤手术或SRS后的辅助WBRT能降低颅内复发率和颅内肿瘤病灶进展致死率,但未能延长生存时间,脑部病灶手术切除后给予WBRT的获益可能不多,甚至会带来神经认知功能损伤的长期效应,因此脑转移病灶切除后患者不常规推荐给予WBRT,而是仅针对瘤床进行SRS。
2.立体定向放疗(SRS)
驱动基因阳性NSCLC无其他部位转移,仅有脑实质寡转移(1~4个)时,优先推荐SRS,对于较大的病灶,经评估认为技术可切时,也可考虑手术切除。
对于不愿意手术或不能耐受手术的脑实质寡转移患者,可考虑SRS,增加肿瘤的局部控制率。手术切除转移瘤可以迅速缓解转移灶占位效应,并且获得肿瘤组织,明确病理诊断,但需根据颅内肿瘤位置、数目及大小等谨慎决定是否手术。
脑转移灶数目在5~10个之间的,JLGK0901研究结果证实SRS和WBRT的总生存期像素,因此,5~10个脑转移灶既可以选择SRS,也可以选择WBRT。
3.靶向治疗
01 EGFR突变
EGFR-TKI治疗
EGFR敏感突变的NSCLC脑转移患者,与不接受TKI治疗的患者相比,EGFR-TKI治疗能使OS明显延长,一线治疗药物优先推荐三代EGFR-TKI(奥西替尼),也可推荐一代或二代EGFR-TKI。
由于血脑屏障的存在,限制了EGFR-TKI向颅内的渗透,因此在使用TKI治疗中,脑转移治疗的疗效与EGFR-TKI血脑屏障的通透性相关。目前三代EGFR-TKI中,血脑屏障渗透率以奥西替尼最佳。各靶向药的血脑屏障渗透性具体见下表1:

FLAURA研究显示,在EGFR敏感突变的NSCLC包括CNS转移患者中,与目前标准一线治疗(厄洛替尼或吉非替尼)相比,奥希替尼将脑转移患者的中位PFS延长至15.2个月,并降低了CNS进展风险,因此在NSCLC合并CNS转移的患者优先推荐奥西替尼。如果由于经济因素不能承担,厄洛替尼也是推荐的药物之一。
总体来说,目前已上市的各代EGFR-TKI血脑屏障渗透性均不甚理想,为了克服这一难关,已研究出了最新一代具有代表性的AZD3759,它显示出了卓越的血脑屏障穿透能力,达到了惊人的100%,在I期临床试验疗效评价中,发现其对颅内病灶的控制活性显示出较大的优势,但其具体疗效尚需进一步的临床研究加以验证。
EGFR突变患者的治疗策略
➤ 之前未使用过EGFR-TKI
—首选奥西替尼,可选厄洛替尼、阿法替尼
➤ 之前使用过EGFR-TKI
—T790M阳性:奥西替尼
—如果MET扩增:联合EGFRTKI和MET抑制剂
—如果T790M阴性:可选择奥西替尼、高剂量厄洛替尼或具有高CNS渗透的新一代EGFRTKI(例如AZD3759)
➤ 疾病进展
—鞘内化疗,全身化疗或免疫治疗
➤ 有症状的较严重患者
—局部放疗
02 ALK融合突变
ALK-TKI治疗
NSCLC患者中枢神经系统转移ALK重排的发生率约为30~50%,而ALK阳性患者中约5%发生脑膜转移,和EGFR-TKI一样,血脑屏障渗透性是决定ALK抑制剂临床疗效最重要的因素,ALK重排阳性NSCLC脑转移患者一线治疗推荐一代TKI联合放疗或新一代TKI单药治疗(目前临床常见ALK抑制剂血脑屏障渗透性见表2)。
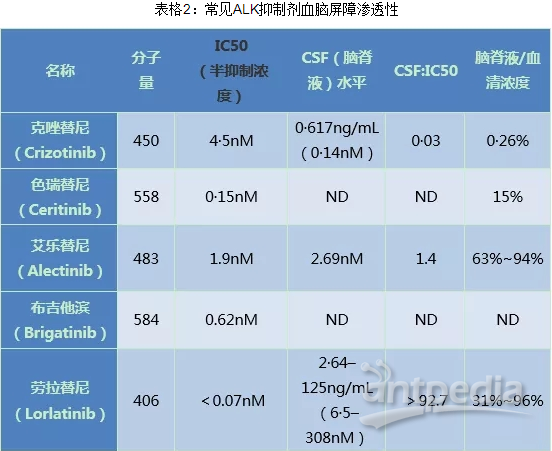
在一项纳入了90例ALK重排阳性NSCLC脑转移患者的单臂研究中,局部放疗联合ALK-TKI后脑转移的中位PFS达到了11.0个月,中位OS为49.5个月。
克唑替尼治疗后脑转移发生率高,使用克唑替尼治疗时,建议针对脑转移灶同时进行放疗。阿来替尼等新一代ALK-TKI药物对脑病灶控制良好,可以单一药物治疗,观察1~3个月后,若病灶最大经缩小不到30%时可联合放疗。
色瑞替尼是比克唑替尼更有效的第二代ALK/ROS1抑制剂,相比克唑替尼,它具有更高的CNS渗透性(15%)。对于克唑替尼治疗后又发生ALK重排的患者,它具有优良的全身和颅内治疗效果。
艾乐替尼对克唑替尼作为一线治疗后的ALK重排NSCLC患者的全身和中枢神经系统的治疗具有显著的疗效,目前美国FDA现已批准脑膜转移作为艾乐替尼的适应症之一。
ALK阳性的NSCLC脑转移患者治疗策略
➤ 之前未使用过ALK-TKI
—首选艾乐替尼,可选克唑替尼
➤ 之前使用过ALK-TKI
—可选艾乐替尼、布吉他滨、色瑞替尼
—可选择lorlatinib或其他新一代TKI进行临床试验
03 TKI治疗期间病灶进展处理
TKI治疗期间出现脑实质病灶进展时推荐继续TKI治疗同时联合局部治疗(酌情考虑SRS/WBRT/手术)或更换新一代TKI。多个回顾性分析显示,驱动基因阳性患者TKI治疗CNS局部进展后,继续TKI治疗联合局部治疗PFS可继续延长4~11个月。
04 局部化疗
前瞻性非随机临床研究发现,在进行全身治疗的基础上联合鞘内注射化疗药物未能延长软脑膜转移患者的生存期,因此不建议常规鞘注化疗药物,仅在全身治疗无效后试用化疗药物鞘注。
能够用于鞘注的化疗药物主要有甲氨蝶呤和阿糖胞苷,但通常效果较差,少数研究发现,甲氨蝶呤鞘注可以延长实体肿瘤包括NSCLC软脑膜转移患者的生存期,但这些研究多在EGFR-TKI广泛应用之前。针对原发肺癌有效但又能被用来鞘注的药物尚需进一步临床研究。
-
产品技术

-
焦点事件
-
焦点事件











