药典委:9101 分析方法验证指导原则标准草案的公示
近日,国家药典委员会宣布,为提升药品质量控制标准,确保分析方法的科学性、合理性和适用性,对现行《中国药典》中的9101分析方法验证指导原则进行修订,并对外发布修订草案的公示。公示期自即日起至2024年8月9日,为期90天,以广泛征求社会各界的意见和建议。

本次修订工作由江苏省食品药品监督检验研究院牵头,主要起草人为王玉、曹玲和李睿。修订内容主要依据国际药品监管机构协调会(ICH)的Q2(R2)、Q14等指导原则,以及各国药典的相关章节,并结合国内实际情况进行。
修订草案的核心内容包括:
文本结构和框架的调整:对原指导原则的结构和框架进行了优化,使之更加清晰和易于理解。
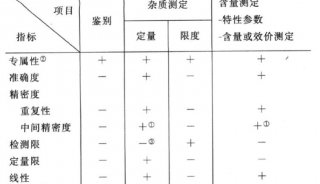
验证参数的重新分类:对分析方法验证中涉及的参数进行了重新分类和归属,以便于更准确地指导实际操作。
多变量方法的考虑:增加了对多变量分析方法的考虑,以适应现代分析技术的发展。
专属性、准确度、精密度验证内容的完善:对专属性、准确度和精密度的验证内容进行了补充和完善,提出了准确度和精密度联合验证的新概念。
系统适用性试验:明确了系统适用性试验在分析方法验证中的重要性,并提供了相应的指导。
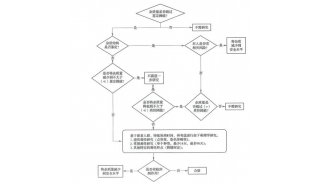
统计学考虑:强调了统计学方法在评价分析方法验证结果中的应用,以及对风险评估的重要性。
以下是通知原文:
关于9101 分析方法验证指导原则标准草案的公示
我委拟修订《中国药典》9101分析方法验证指导原则。为确保标准的科学性、合理性和适用性,现将拟修订的9101分析方法验证指导原则公示征求社会各界意见(详见附件)。公示期自发布之日起三个月。请认真研核,若有异议,请及时在线反馈,并附相关说明、实验数据和联系方式。来函需打印后加盖公章,个人来函需打印后本人签名,并邮寄至我委通讯地址。
公示期满未回复意见即视为对公示标准草案无异议。
联系人:徐昕怡、朱冉
电话:010-67079522、67079581
通信地址:北京市东城区法华南里11号楼 国家药典委员会办公室
邮编:100061

附件
附件 9101分析方法验证指导原则草案公示稿(第一次).pdf