DELFIA经典技术应用于单抗研发及细胞治疗(一)
ADCC简介
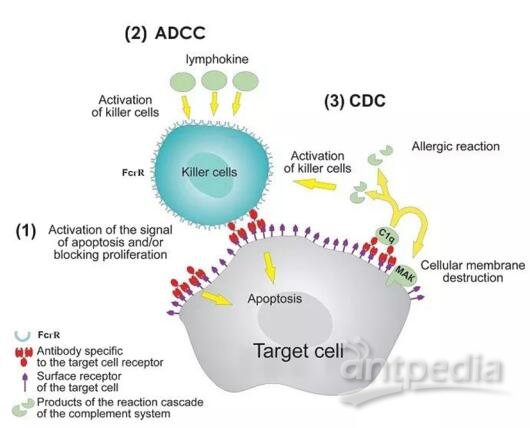
Fc区域主要介导以下三类活动:
1. 通过结合表达在Natural killer (NK)等免疫细胞表面上的FcγR(Fcγ receptors)激活抗体依赖的细胞介导的细胞毒性作用(Antibody-dependent cell-mediated cytotoxicity,ADCC)
2. 通过结合血清补体C1q激活补体依赖的细胞毒性作用(Complement-dependent?cytotoxicity,CDC)
3. 通过结合新生儿Fc受体(Neonatal Fc receptor ,FcRn)延长抗体半衰期。
今天我们主要关注ADCC,其不仅是机体通过抗体清除被病毒或其他病原物感染细胞的主要途径,也是目前治疗性抗体发挥临床效果的(Mechanism of Action ,MOA)核心机制之一[1]。因此,对于抗体新药研发和改造,仿制药开发和研发过程中抗体质量及功能的分析,都离不开ADCC的检测。同时,在生物药和免疫调节药物的临床试验中,ADCC活力也是必须的ex vivo指标之一。在此,我们以ADCC检测为切入点,向大家展示珀金埃尔默的DELFIA技术平台是如何助力抗体制药的。
图片引用自参考资料[1]
基于DELFIA技术的ADCC检测
从细胞水平来说,ADCC本质上属于免疫细胞介导的杀伤。因此,常见的针对细胞杀伤(注意不是细胞活力)的检测方式,如经典的51Cr释放法,LDH检测,和Calcein 释放法等都可以用于ADCC检测。从原理上,这些方法可分为直接的检测靶细胞在效应免疫细胞作用下的裂解程度,如51Cr释放法;和间接的检测效应细胞的活化,如NFAT-RE-luc报告基因法和监测剩余的细胞活力来评估细胞杀伤,如化学发光法等。间接法的缺点是不能直接模拟体内ADCC过程。利用DELFIA技术的DELFIA® EuTDA(货号AD0116)细胞毒法属于直接检测法,更能反映ADCC的MOA。与51Cr释放法形式类似,DELFIA® EuTDA细胞毒法利用荧光放大配体BATDA特异的标记靶细胞。BATDA能迅速进入细胞,并在水解作用下形成亲水的TDA留在细胞内,并在靶细胞裂解下释放,和DELIFA Eu试剂相结合形成强荧光、稳定的螯合物EuTDA用于检测。更详细的原理介绍可参考我们的微信端公众号[2]和应用材料[3]。

图片引用自参考资料[3]
作为放射性检测的替代方法,更为安全的DELFIA® EuTDA细胞毒法在ADCC活力检测中具有众多优势。相较于无法区分非特异死亡的LDH检测,EuTDA法不受效应细胞死亡和裂解的影响,降低背景的同时提升了检测的窗口和稳定性。相较于Calcein,BATDA能有效标记脆弱细胞,迅速被细胞摄取和在细胞裂解下完成高效的释放,为ADCC检测提供了稳定的检测窗口和易于标准化等优势。同时,EuTDA细胞毒法不受效应细胞限制,灵活支持利用多种原代免疫细胞(如PBMC和NK细胞)和更为稳定的改造细胞系的ADCC检测。从检测模式上EuTDA方法为时间分辨荧光(Time-Resolved Fluorescence,TRF),因此拥有TRF本身的众多优势,包括不受来源于培养基和血清等的背景荧光干扰,高稳定性和重复性等。此外,靶向红外区的检测能有效避免检测样本来带的干扰,并为多重检测打下基础。最后,对自动化和小型化的支持已让EuTDA法逐渐成为大分子药物研发中ADCC检测的标准方法[4]。在此,我们通过几个经典案例向大家介绍基于DELFIA技术的ADCC检测是如何助力大分子药物研发的。
单抗研发领域之Fc区域改造
在此,我们向大家介绍抗体改造的先河研究[5]。在结构解析的基础上,该研究引入AlphaScreen高通量筛选平台,通过竞争法鉴定出FcγRIIIa高亲和力的Fc区域变体。AlphaScreen的亲和力结果进一步由Biacore SPR 确认。除了检测变体和FcγRIIIa之间的亲和力,AlphaScreen还用于确认变体和抑制性IgG受体FcγRIIb之间的亲和力,从而获得变体和RIIIa/RIIb的相对亲和力比值。结果显示A330L 突变和S239D/I332E相结合能提高对激活性FcγRIIIa的亲和力的同时降低和抑制性受体FcγRIIb之间的亲和力,显著提升RIIIa/RIIb的相对亲和力比值(4->9, 针对Trastuzumab)。