E2Dap-UbDha能够与E3酶Nedd4和Parkin实现有效交联
泛素化作为最为复杂的蛋白质翻译后修饰形式之一,在多种细胞过程中发挥关键调控作用。经典的泛素化过程依赖于E1-E2-E3酶高度有序的级联反应来完成。其中,泛素E3连接酶直接负责识别底物蛋白并将其泛素化,在决定泛素修饰特异性方面扮演关键角色。半胱氨酸依赖型 (HECT, RBR) E3酶发挥活性时,需首先形成瞬时动态的E3~E2~Ub硫酯中间体。近期人们开发了一系列基于活性的E2-Ub探针,用来捕获E3-E2-Ub硫酯转移中间体,为研究E3酶的催化机制提供了机遇。然而,现有的E2-Ub活性探针均依赖于通过缀合化学反应修饰表达的E2变体来获取,使得探针结构的可塑性受到重组技术以及缀合化学的限制。
近日,清华大学刘磊教授团队使用基于蛋白酰肼法的蛋白质化学全合成方法,发展了一种新结构的E2Dap-UbDha蛋白质探针。功能研究表明该探针能够与E3酶Nedd4和Parkin实现有效交联,进一步机制研究为Parkin催化E2~Ub转硫酯反应的分子机制提供了新线索。
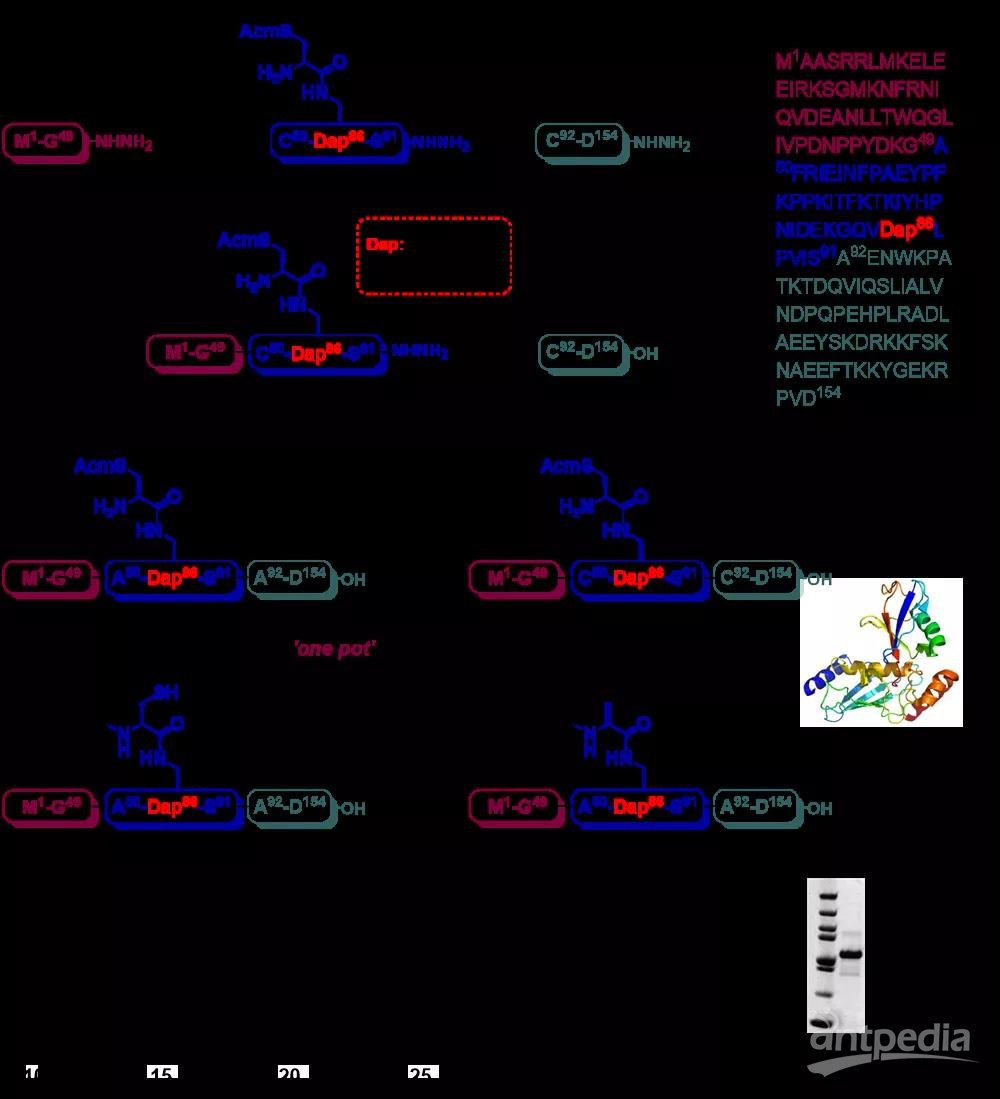
在具体的研究中作者首先利用微波固相合成法,高效率合成了三个多肽酰肼片段。随后经过三步蛋白酰肼连接,一步脱硫以及一步Dha生成反应,作者以5%的总产率高效制备了新型Ubch7Dap-UbDha探针。探针的结构经HPLC、ESI-MS、FPLC、SDS-PAGE等手段得到确证。
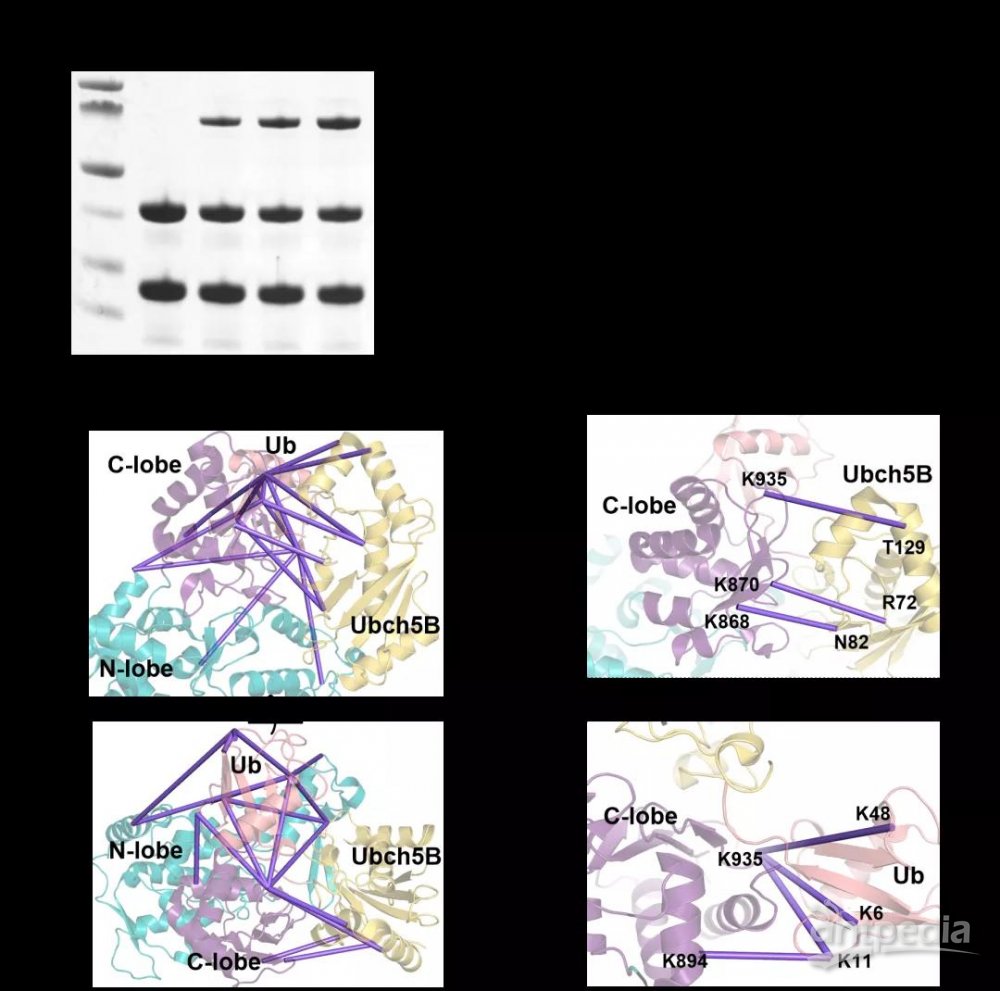
SDS-PAGE以及HPLC-MS结果显示,Ubch7Dap-UbDha探针能够与HECT家族E3酶Nedd4基于活性高效交联,从而实现Nedd4-Ubch7-Ub中间体的捕获。针对Nedd4-Ubch7-Ub复合物的化学交联质谱研究表明,Nedd4-Ubch7-Ub采取了一种闭合的空间构象。
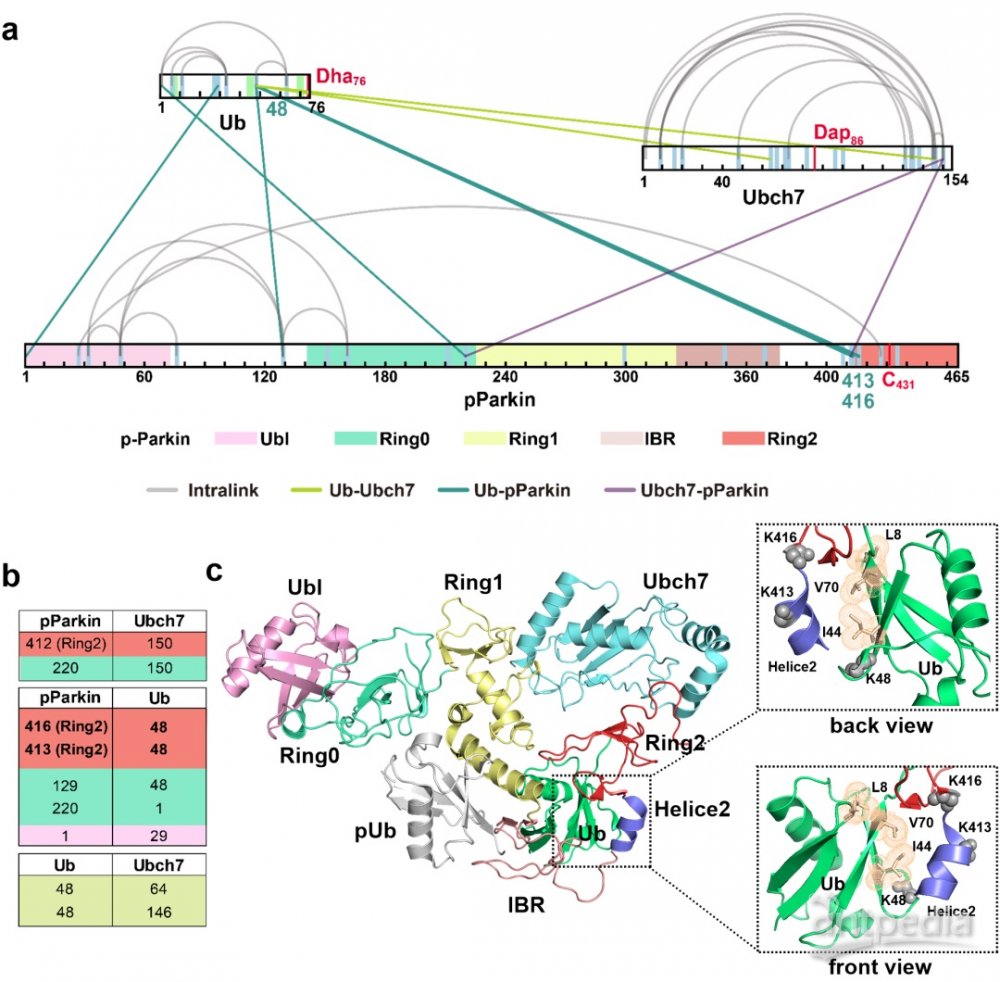
Ubch7Dap-UbDha探针能够与RBR家族E3酶pParkin基于活性交联,从而形成pParkin-Ubch7-Ub硫酯转移中间体。化学交联质谱分析pParkin-Ubch7-Ub复合物的结构表明,在转硫酯过程中,pParkin Helice2可能与Ub Ile44疏水口袋相互作用,进而起到稳定E2-Ub的作用。
在该工作中,刘磊教授团队设计并合成了一种新型E2Dap-UbDha 蛋白质探针,展示了蛋白质化学合成在获取新结构活性交联探针工具上的应用。该探针丰富了泛素探针工具箱,为半胱氨酸型E3酶的结构机制研究提供了新机遇。







