新一代成像流式技术在免疫细胞吞噬、CAR-T免疫疗...(一)
新一代成像流式技术在免疫细胞吞噬、CAR-T免疫疗法等最新热门话题中的应用
新一代成像流式技术的最新热门应用
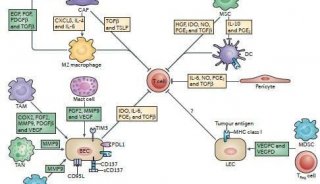
近年来,生命科学研究工具不断推陈出新,新一代的测序、成像、自动化检测等尖端技术革新了整个生命科学行业的认知维度,不仅使得经久不衰的科研话题获得新的突破,如细胞间相互作用、自噬和细胞信号通路等,同时也为一些过去无法解决的难题提供了新思路,例如癌症新疗法CAR-T。本文精选了Nature、Science等高分文献,探讨新一代的成像流式技术在如下热门话题中的应用。
免疫细胞吞噬
细胞间相互作用一直是免疫学中的热点。免疫细胞可以吞噬靶细胞从而实现自我修复的功能,也可以通过受体配体结合实现不同细胞间的物质交换。由于传统方法无法对单个细胞成像,因此细胞间相互作用的方式一直缺乏直观有效地证据。在2009年4月16日,David Sancho等人在Nature上发表了一篇题为“Identification of a dendritic cell receptor that couples sensing of necrosis to immunity”的文章,成功的证实了树突状细胞通过SKY耦合C型凝集素受体CLEC9A识别并吞噬坏死细胞,并且采用量化成像流式技术识别并量化统计的细胞吞噬的情况。

图一:通过左侧成像流式结果图可以清楚的判别细胞黏连体(’False’ postive)和发生吞噬的细胞(’True’ positive),从而排除了假阳性结果的干扰。
信号转导
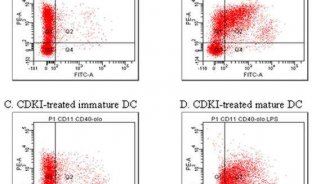
除了免疫细胞的吞噬之外,细胞间的相互作用还包括不同细胞通过配体受体的结合进行细胞间的信号转导。最常见的是获得性免疫反应中,T淋巴细胞与抗原递呈细胞之间免疫突触的形成。在正常细胞中,与免疫突触形成相关的蛋白淋巴细胞功能相关抗原-1(LFA-1),细胞表面抗原CD3,以及F-actin均匀分布在细胞表面;而当免疫突出形成时,这些蛋白在两个细胞接触的位置发生凝集。正是根据这一机制,2009年,Babak H. Hosseini等人成功的使用成像流式技术检测到HEL多肽处理细胞可以促进免疫突触的形成,并将科研成果发表在PNAS上。由此也证明成像流式在检测免疫突触形成中独有的优势。

图2:
图2A显示,未使用HEL多肽处理的样本中LFA-1,CD3和F-actin并没有发生凝集,因此没有免疫突触形成。细胞经过HEL多肽处理后,LFA-1,CD3和F-actin并发生凝集,证明有免疫突触形成。
图2B的量化统计结果显示,HEL多肽促进免疫突触形成的结果具有统计学意义。
自噬
自噬是细胞在演变进化的过程中保留下来的一个分解代谢过程,其主要是将胞浆内的物质运输到溶酶体内进而被分解代谢,藉此实现细胞本身的代谢需要和某些细胞器的更新。研究自噬的传统方法主要是通过荧光显微镜或者共聚焦观察自噬小体/自噬溶酶体的形成。由于显微镜的视野限制,无法进行高通量样本或者混合细胞样本,比如临床血液样本进行分析。2012年,Kanchan
Phadwal等人在《Autography》发表题为“A novel method for autophagy detection in
primary
cells”使用量化成像流式技术对人血中白细胞旳自噬进行了量化分析,并且通过对原代细胞和细胞系自噬的相关基因的研究,证实了T体细胞的自噬活性明显高于B细胞,而随着DNA损伤水平的升高CD8+
T细胞的自噬明显下降。从而为随着年龄的增长,免疫系统功能下降提供了合理的解释。

图3:由图可以看出,发生自噬的细胞LC3在细胞内发生的聚集,因此在细胞内,荧光信号为散点。加了抑制剂(Basal+I)后,自噬被抑制,因此LC3在细胞内是弥散分布的。