抗体新药诞生,200万非小细胞肺癌患者有救了
今日,FDA官网信息显示,重磅PD-1抑制剂Keytruda已经获得美国FDA批准,与含铂化疗联用作为手术前新辅助治疗,并在手术后单药作为辅助治疗,用于治疗可切除(肿瘤≥4厘米或淋巴结阳性)的非小细胞肺癌(NSCLC)患者(肿瘤≥4厘米或淋巴结阳性)。同时,Keytruda获得欧盟委员会(EC)批准,作为单药辅助疗法,治疗接受完全切除和含铂化疗后有高风险复发的NSCLC患者。
肺癌是最常见的癌症类型之一,也是癌症死亡的主要原因。仅在2020年,全球肺癌确诊人数超过220万人,并造成超过180万人死亡。肺癌可大致分为NSCLC和小细胞肺癌(SCLC)两大类,其中NSCLC是最高发的肺癌类型,约占肺癌病例81%。约44%非小细胞肺癌患者在确诊时已是晚期。
Keytruda是一种人源化的抗PD-1单克隆抗体,可以阻断PD-1与其配体PD-L1、PD-L2的结合,进而激活T淋巴细胞。此作用可能增强体内免疫系统侦测与抵抗肿瘤细胞的能力。2014年9月,Keytruda首次获FDA批准治疗晚期黑色素瘤,并在后续获批作为一线疗法治疗转移性NSCLC患者。在中国,Keytruda也已获批多项适应症,涵盖黑色素瘤、NSCLC、头颈部鳞状细胞癌、结直肠癌、食管癌与肝癌。

FDA的批准主要基于名为KEYNOTE-671的3期临床试验,近日发布的总生存期数据显示,基于Keytruda的围手术治疗方案与对照组相比,为总生存期带来统计显著并具有临床意义的改善。这是在此类患者中首个显示统计显著总生存期获益的3期临床试验。此前发表的无事件生存期(EFS)数据显示,Keytruda组与对照组相比,减少疾病复发,进展或死亡的风险42%(HR=0.58,[95% CI,0.46-0.72],p<0.00001)。接受基于Keytruda治疗方案的患者,中位EFS尚未达到(95% CI,34.1-NR),接受单独化疗的患者的EFS为17个月(95% CI,14.3-22)。
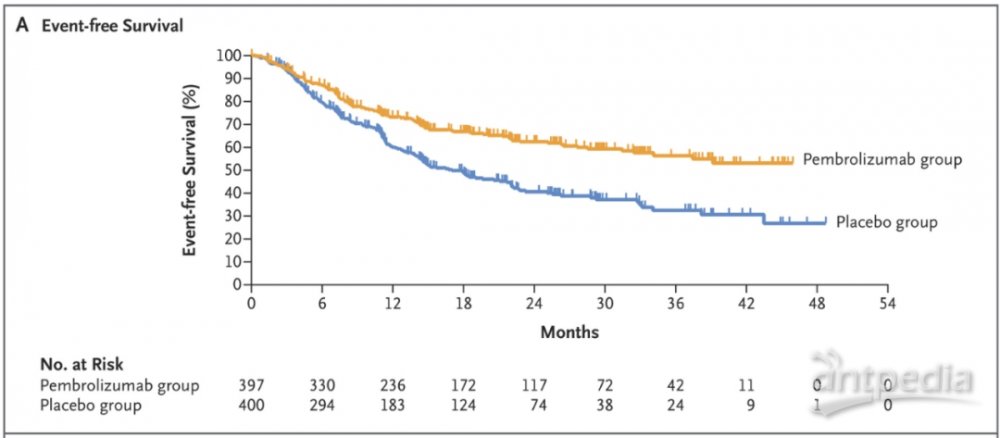
KEYNOTE-671试验的无事件生存期结果
欧盟委员会的批准是基于3期临床试验KEYNOTE-091,试验结果显示,中位随访时间为46.7个月时,Keytruda为无病生存期带来具有临床意义的改善,将疾病复发或死亡风险降低24%(HR=0.76,[95% CI,0.64-0.91])。
-
科技前沿
-
科技前沿
-
焦点事件
-
焦点事件