Cell:转移性前列腺癌的磷酸化蛋白质组学研究
癌症基因组学有望通过揭示驱动个体患者肿瘤细胞的遗传突变来实现个体化癌症治疗。但解读这一基因组数据仍然是个挑战。一些突变和其他遗传改变对癌细胞的影响,呈现在与细胞生长、增殖和其他癌症生物学标志相关的复杂分子互作(信号通路)网络中。通过绘制在前列腺癌细胞中活化的一些关键信号通路,研究人员能够确定可以采用药物靶向来破坏这一疾病的这些信号通路中的“主控开关”。
来自加州大学洛杉矶分校等处的研究人员采集了恶性转移前列腺癌患者尸体的临床组织样本,通过一系列复杂的分析确定了来自每位患者的癌细胞特征。而且他们也对生成的数据集进行一种新颖的计算分析,绘制出了每位患者癌细胞中信号通路的个体化图表,其中的一些细节表明了潜在的治疗靶点。
这一研究成果公布在Cell杂志上,文章的通讯作者,加州大学基因组学研究所癌症与干细胞基因组学主任Josh Stuart说,“这就像拥有了每个肿瘤的蓝图。这是我们对个体化癌症治疗的梦想,因此我们不只是猜测哪些药物将会起作用,而能够根据是什么驱动了患者的癌症来选择药物靶点。”
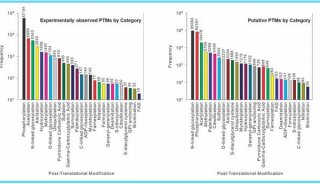
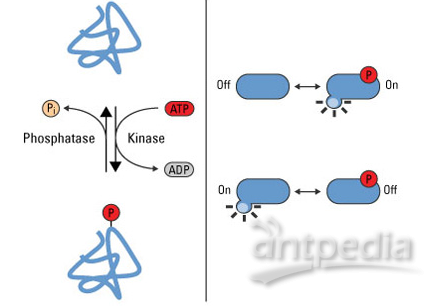
磷酸化蛋白质的酶称作为激酶,许多的新型癌症药物都是激酶抑制剂。全面分析前列腺癌肿瘤和细胞的“磷酸化蛋白质组”,揭示细胞蛋白的磷酸化状态改变,是这项研究一个重要的组成部分。领导这项研究中磷酸化蛋白质组学研究的Justin Drake表示,“在传统的基因组学和转录组学之外拥有了磷酸化蛋白质组学数据,使得我们能够更全面地认识这一疾病中的异常信号。我们开发了一种方法整合多个这些大型数据集了解了在个体患者中是什么驱动了这一疾病。”
这项研究揭示出了抗雄激素治疗耐药背后的一些机制。在许多病理中一个突变导致了雄激素受体蛋白发生了改变。在其他情况下,一些替代激酶信号通路使得癌细胞能够维持生长,即便雄激素受体信号被阻断。
在分析每位患者肿瘤细胞基础上获得的个体概况,揭示出了可用来优先排列最有可能在这些病例中发挥疗效的药物的一些临床相关信息。用来生成这些个体概况的工具缩写是pCHIPS,研究人员建立了一个在线的pCHIPS资源,允许用户根据自身的数据预测患者特异性的网络及利用pCHIPS方法显示这些结果。
将这些方法用于前列腺癌细胞系,研究人员发现采用基因组学数据或磷酸化蛋白质组数据都可以精确地预测药物敏感性。这非常的重要,因为在这项研究中对临床样本完成的一套全面的分析不太可能用于大多数的患者。而基因组学的临床应用正在增长。