Nature:张鹏等揭示ECF转运蛋白跨膜转运叶酸的分子机制
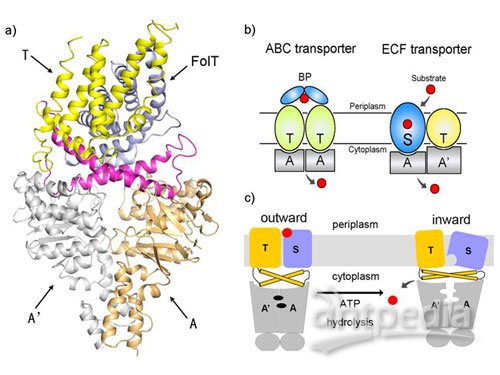
能量耦合因子型(ECF)叶酸转运蛋白面向内(inward-facing)的晶体结构
4月14日,中国科学院上海生命科学研究院植物生理生态研究所张鹏课题组首次解析了来源于乳酸杆菌的能量耦合因子型(Energy Coupling Factor,ECF)叶酸转运蛋白面向内(inward-facing)的晶体结构(a),揭示了ECF转运蛋白跨膜转运叶酸的分子机制。相关研究论文刊登在了近期出版的《自然》(Nature)杂志上。
叶酸参与细胞内众多重要生化过程,包括DNA和氨基酸的合成。植物以及多数微生物能自身合成叶酸,而人和动物体不能合成叶酸。研究表明人体叶酸摄入不足会导致胎儿神经系统发育的缺陷、巨幼细胞贫血等重大疾病。据统计我国居民中叶酸摄入不足的比例高达20%,每年有近10万新生儿因叶酸缺乏导致神经系统发育缺陷。因此,通过育种途径培育富含叶酸的作物品种对提高国民健康水平具有重要意义。虽然科学家们经过长期的研究阐明了叶酸的合成途径,并发现叶酸是通过多种转运蛋白在细胞或者细胞器之间穿梭,但关于其跨膜转运的机制一直不清楚。
ECF转运蛋白属于新的ABC(ATP Binding Cassette)转运蛋白,主要转运多种B族维生素和微量元素。该复合体由细胞膜上底物结合蛋白S、和由膜结合蛋白T、胞内ATP结合蛋白A/A’组成的能量耦合模块构成。ECF转运蛋白分为耦合模块专用型和共享型两类:前者每一种S蛋白均有各自独立的能量耦合模块;后者有几种不同的S蛋白,但共享相同的能量耦合模块。与经典的ABC转运蛋白中的内向转运蛋白相比,其显著特点在于不存在膜外底物结合蛋白BP(b)以及不同S蛋白可以共享能量耦合模块。
此次解析的叶酸ECF转运蛋白结构是迄今第一个ECF型ABC转运蛋白复合体的结构,也是叶酸跨膜转运蛋白的首个结构。研究发现:四个组成该复合体的蛋白中,T蛋白的五个跨膜alpha螺旋与三个胞内负责能量耦合的alpha螺旋近似垂直,形成 “L”型构象,两个互相交叉呈“X”型的胞内alpha螺旋构成T蛋白的L型短臂;S蛋白则由六个跨膜alpha螺旋组成,斜插在膜内且躺在T蛋白“L”型短臂上方; A/A'蛋白并排排列在T 蛋白“L”型短臂的下方,通过表面的凹槽与T蛋白中呈“X”型的两个alpha螺旋两端的精氨酸loop相互结合。这一结构的解析揭示了ECF转运蛋白与经典ABC转运蛋白的显著差异、能量耦合的结构基础,结合转运活性实验以及与经典ABC转运蛋白的比较分析,提出了叶酸通过ECF转运蛋白跨膜转运机制的模型(c)。这是膜转运蛋白研究领域的重大突破,一方面使人们对ABC转运蛋白跨膜转运的机理有了全新的理解,更为重要的是为人们理解维生素(特别是叶酸)如何跨细胞膜转运进入细胞的过程迈出了一大步。(同一期Nature 上报道了清华大学施一公教授研究组的另一ECF转运蛋白的结构,得出了与我们相似的结论。)
中科院上海生科院植物生理生态研究所张鹏课题组的博士生许可、赵琴、助理研究员张敏华和生化细胞所丁建平课题组的助理研究员俞芳作为文章的共同第一作者。该研究得到了国家科技部、上海市、中科院和依托单位的资助。感谢上海光源BL17U线站在实验数据收集中的支持与帮助。