分子克隆-蛋白表达实验指南(八)
15. 小量蛋白诱导表达
该步骤的目的是检测蛋白是否在上清存在表达。低温时蛋白易于表达于上清,因此小量蛋白诱导表达以20或30C为培养温度。
1. 挑一单克隆的菌落于5ml含有相应的抗生素的LB培养液中,37℃振荡培养过夜(8-16h)。
2.
过夜培养液加入三瓶50ml含有相应的抗生素LB锥形瓶中(用250ml以上锥形瓶摇菌,保证培养液体积不超过菌液体积的25%,给细菌良好的生长环境),20/30℃振荡培养至OD600达到0.4-0.6。一般转种诱导的比例为1:100,或者1:50(实际条件数可根据情况调整,如IPTG梯度、延迟诱导,加无水乙醇等)
3. 取1ml培养液测其OD600值,收集细菌,按1ml菌液×OD600加入100μl的比例加入2×上样缓冲液,混匀,-20℃保存或直接上样。
4. 诱导时加入相应的IPTG浓度(0.1, 0.5,
1mM),20/30℃振荡培养。每隔1h取1ml样品,以观察目的蛋白表达是否会在一定时间降解,诱导4h左右。若IPTG浓度较低,如0.01,0.001mM,可诱导过夜。(低IPTG浓度可降低目的蛋白合成的速度,使细菌有相对充分的时间对目的蛋白进行折叠,形成可溶蛋白)
5. 根据蛋白分子量大小配置相应浓度的SDS-PAGE胶。(50KD蛋白10%或12%)
6. 诱导大约4h后收集菌液,取40ml菌液于50ml离心管中,7000rpm,15min,4C。去上清,离心管置于冰上15min。
7. 以每100ml OD600为1.5菌液加入4ml 1×PBS的比例重悬湿菌,先用枪头打碎菌块,再vortex
1×PBS中可加入低浓度变性剂如Triton-100(0.1%-3%), Triton-100等帮助目的蛋白融解,同时不会影响目的蛋白活性。
8. 超声破碎前加入终浓度为1mM的PMSF或其他蛋白酶抑制剂,防止目的蛋白降解。PMSF有剧毒,拿装PMSF的试管时必须带上手套。
9. 取1ml PBS重悬菌液于1.5ml
EP管中超声,超声时EP管置于冰上(超声时不定期查看,防止EP管掉入冰水中)。10s超声,15s间隔,200w,20-25次。剩余的重悬菌液4C保存,作为诱导后的对照。若制备的超声后样品需过夜,过夜前再加入一定量的PMSF。PMSF在水中不稳定,活性时间仅为数小时。
10. 4C,12000rpm,15min。上清置入新EP管中,沉淀用1ml PBS充分重悬。
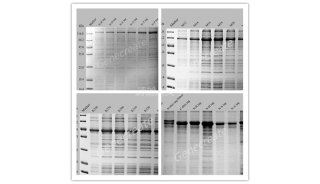
11. 取10ul超声前、超声后的上清和重悬沉淀上SDS-PAGE。
12. 将收集的菌液在水中煮5min,按照相应的要求上样 ,120V电压走浓缩胶,加电压至150V进入分离胶电泳,直到染料刚好走到胶底。
13.
取下胶,考马斯亮蓝染色至少30min(染液若是新配的,染20min就够了),脱色液脱色。若急需看到结果,可以将胶在500ml蒸馏水中煮沸两次即可看到条带。
注意:
a. 20C诱导前可以使细菌先37C培养,加快细菌生长速度。但诱导前30min必须在20C培养,以使细菌适应20C的生长环境。
b. 在处理蛋白的过程中,尽量在冰上操作,避免蛋白变性或降解。
c.
在蛋白表达中,小量表达摸索条件是非常关键的,往往也是耗费时间最多的步骤,为了能在上清中获得目标蛋白,有必要对每一个表达的蛋白摸索以下条件:IPTG浓度(最好过夜),温度,乙醇,延迟诱导(OD为1.0时诱导)等。同时在处理蛋白时,也应用1%~3%的triton-100摸索条件。