基因敲除与RNA干扰的关系
20世纪80年代初,胚胎干细胞分离和体外培养的成功为基因敲除奠定了技术基础。1985年,首次证实的哺乳动物细胞中同源重组(homology recombination, HR)的存在为基因敲除奠定了理论基础[2]。为了编辑基因,传统的靶向特定等位基因的同源重组技术被使用,但是,这个方法在当年来说,存在效率低、劳动成本高的缺点,严重制约了基础研究和临床应用,这就需要科学家探索更为简洁高效的基因编辑技术。
为了实现利用简单的方法使特定基因失去功能,科学家研发出了RNA干扰(RNA interference,RNAi)技术,希望更易于研究哺乳动物细胞的基因功能,它具有操作简单、效果明显等优点。但RNAi不能作用于所有基因和某些细胞类型(如神经元),而且存在位置效应、临时性和不完全敲除的缺点[3]。
随着各种基因编辑技术的进步,如:锌指核酸酶技术(zinc finger nuclease,ZFN)[4]、转录激活样效应物核酸酶技术(transcription activator-like effector nucleases,TALENs)[5]和成簇的规律间隔的短回文重复序列系统(clustered regularly interspaced short palindromic repeats (CRISPR)/CRISPR -associated (Cas) 9 system,CRISPR/Cas9)[6]等技术技术更迭,基因编辑领域也发生了革命性的改变。
今天小编就带大家重新进入一下CRISPR/Cas9 技术和RNA干扰的世界吧,一起来回顾历史哦~
CRISPR/Cas9基因敲除
基因敲除(knockout)是指利用遗传工程技术,针对某个特定已知基因序列,改变生物的遗传基因,令其功能丧失作用,并进一步对生物体造成影响,进而推测出该基因的生物学功能。CRISPR/Cas9 是近年来发展最快的新基因敲除技术,它广泛存在于许多原核生物基因组中,其中的域型CRISPR/Cas9 系统可以依赖Cas9内切酶家族靶向剪切外源 DNA。转录后,每个crRNA (CRISPR RNA)和 tracrRNA (trans-activating crRNA)结合在一起,并和Cas9核酸酶形成一个复合物[3]。Cas9核酸酶在crRNA 的指引下,识别保守的间隔相邻基序(protospacer adjacent motif,PAM)并靶向结合到 DNA 上,从而切割 DNA。这个技术操作简单快捷、成本低廉、脱靶效应较低,已经成为基因功能研究领域强有力的武器,极大地加速了药物靶点的筛选验证及新药的研发。
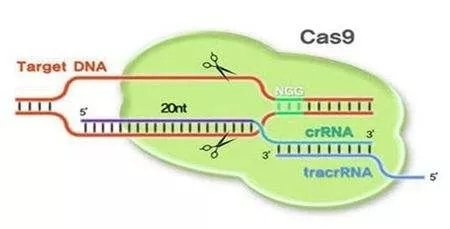
图3. CRISPR/Cas9技术工作示意图[8]
RNA干扰
RNA干扰是指小分子双链RNA可以特异性地降解或抑制同源mRNA表达,从而抑制或关闭特定基因表达的现象,其主要是通过短干扰RNA (short interfering RNA,siRNA)和短发夹RNA(short hairpin RNA,shRNA)来调节基因表达[9]。dsRNA在Dicer 酶的作用下可产生一系列长度为21~22 nt的siRNAs,后者在细胞内 RNA 解旋酶的作用下解链成正义链和反义链,随后由反义siRNA再与体内一些酶(包括内切酶、外切酶、解旋酶等)结合形成 RNA 诱导沉默复合物(RNA-induced silencing complex,RISC)。具有核酸酶功能的RISC与外源性基因表达的mRNA同源区进行特异性结合,在结合部位切割 mRNA。被切割后的断裂mRNA随即降解,从而诱发宿主细胞针对这些mRNA的降解反应,封闭内源性基因的表达,使该基因失活,最终达到基因沉默的作用[3]。
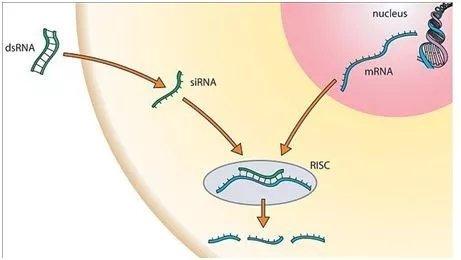
图4. RNA干扰的示意图[10]
CRISPR/Cas9基因敲除与RNA干扰优势对比
就目前来说,CRISPR/Cas9 技术的效率已经非常高,基本可以在经过一次打靶过程就可以得到基因敲除的小鼠,而传统的基于同源重组的技术则需要更长的时间。基于CRISPR/Cas9基因敲除技术其成本低、制作简便、快捷高效的优点,让它迅速风靡于世界各地的实验室,成为科研、医疗等领域的有效工具,更被认为能够在活细胞中最有效、最便捷地“编辑”任何基因;作为一种新型的靶向基因编辑技术,CRISPR/Cas9 技术已成功在斑马鱼、小鼠和大鼠等多个物种中得到了广泛应用,此外该项技术不存在动物物种的限制,其在植物基因修饰中也取得了突破,如大豆、烟草、水稻和小麦中都取得了成功。
CRISPR 技术的优势是能永久性地改变基因组DNA的序列,但在基因沉默方面RNAi 技术也有其独特的优势。具体来说首先RNAi无需引入额外的蛋白质因子,更安全,成本更低;其次RNAi 是一种转录后水平的可逆的基因沉默技术,只需通过siRNA的添加与否,或使用小分子化合物调控siRNA表达载体上诱导型启动子的活性就能实现对靶基因的沉默与开启;最后RNAi在转录后水平调节基因的表达,故设计siRNA时只需参考转录组数据[11]。
应用
1、CRISPR/Cas9基因敲除
CRISPR/Cas9技术在药物研发的功能基因筛选过程中,只需要将一个sgRNAs文库导入细胞中,再通过相关表型的评估,即可实现对基因组的大规模定点编辑和筛选,进而揭示基因的生理功能,为新药研发提供可靠的靶标。
CRISPR/Cas9技术不仅仅限于基因敲除,包括大片段的敲进,点突变,人源化替换等策略都已经在动物模型构建中已大展身手,大大缩减了构建动物模型的时间和经费。而且已广泛应用于各种的基因编辑模型构建(主要包括肿瘤和干细胞系)。此外该技术应用于人体的基因治疗也在快速发展过程中,将为人类疾病的治疗带来巨大的帮助[12]。
2、RNA干扰
① 基因功能研究
由于RNAi具有很好的特异性和有效的干扰活力,可以使特定基因沉默,使其功能丧失或降低表达,因此可以作为功能基因组学的一种强有力的研究工具[9]。已有研究表明siRNA能够在哺乳动物中抑制特定基因的表达,而且抑制基因表达的时间可以控制在发育的任何阶段,产生类似的基因敲除的效应。
② 病毒性疾病的治疗
研究表明,人们通过合成一段针对特定病毒基因的siRNA,并将之导入该病毒感染的细胞,能够有效地抑制该病毒的复制,阻断病毒对细胞的感染。并且,可贵的是,siRNA在病毒感染的早期就能发挥抑制作用。因而,siRNA可用来治疗病毒性疾病。
③ 肿瘤病的治疗
肿瘤是多个基因相互作用的基因网络调控的结果,传统技术诱发的单一癌基因的阻断不可能完全抑制或逆转肿瘤的生长,而RNAi可以利用同一基因家族的多个基因具有一段同源性很高的保守序列这一特性,设计针对这一区段序列的siRNA分子,只注射一种siRNA即可产生多个基因同时剔除的效果,也可以同时注射多种siRNA而将多个序列不相关的基因同时剔除。
总结
综上所述,在基因编辑技术中,基因敲除技术与RNAi技术各有千秋,都被积极地应用于一些生物问题的研究,包括一些人类疾病,极大地满足了研究人员操作不同类型基因组的目的,不仅可以作为基因编辑的工具,也可用于基因表达调控。这就好比“宝刀屠龙,号令天下;倚天不出,谁与争锋”。
今天的干货就暂时到这里啦,各位宝宝们是不是墨水满满的呢,咳咳,如果感兴趣,一定要随时关注留意小编,定不会错过你想要的,咱们下次再会~小编悄悄地来,又轻轻地走,不要带走任何遗憾哦!
参考资料
[1]https://www.cnblogs.com/pythonicanus/p/10111230.html
[2]Smithies O, Gregg R G, Boggs S S, et al. Insertion of DNA sequences into the human chromosomal β-globin locus by homologous recombination[J]. Nature, 1985, 317(6034): 230-234.
[3]李 妤,赵红业,崔 勇,魏红江,李梅章. 基因编辑技术的研究进展[J].生命科学研究,2017,21(3)
[4]Hauschild-Quintern J, Petersen B, Cost G J, et al. Gene knockout and knockin by zinc-finger nucleases: current status and perspectives[J]. Cellular and Molecular Life Sciences, 2013, 70(16): 2969-2983.
[5]Cermak T, Doyle E L, Christian M, et al. Efficient design and assembly of custom TALEN and other TAL effector-based constructs for DNA targeting[J]. Nucleic Acids Research, 2011, 39(12): e82.
[6]Cong L, Ran F A, Cox D, et al. Multiplex genome engineering using CRISPR/Cas systems[J]. Science, 2013, 339(6121): 819-823
[7]http://www.sohu.com/a/284394775_704327
[8]https://www.iiiff.com/article/24961
[9]Wilson R C, Doudna J A. Molecular mechanisms of RNA interference[J]. Annual Review of Biophysics, 2013, 42: 217-239
[10]http://blog.sina.com.cn/s/blog_445dac3b0102x8kb.html
[11]尚仁福,吴立刚. RNA干扰的机制及其应用[J]. 生命科学,2016,28(5)




















