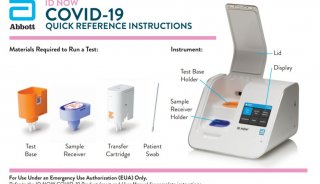
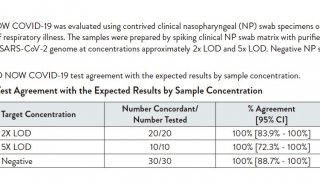
美国FDA授予rezafungin合格传染病产品资格和快速通道地位
Cidara Therapeutics是一家专注于开发包括免疫疗法在内的新型抗感染药物的生物技术公司。近日,该公司宣布美国食品和药物管理局(FDA)已授予抗真菌药物rezafungin的合格传染病产品(QIDP)和快速通道地位。具体而言,QIDP资格授予静脉注射剂型rezafungin预防性治疗项目,用于接受异基因骨髓移植的成人患者预防侵袭性真菌感染。之前,rezafungin已被授予治疗念珠菌引起的侵袭性真菌感染的QIDP。
rezafungin是一种新型抗真菌棘球白素(echinocandin),目前正开发作为一种每周一次的高暴露疗法,用于治疗和预防严重的侵袭性真菌感染,包括:治疗念珠菌和侵袭性念珠菌病,以及预防常见真菌病原体(念珠菌、曲霉、肺孢子虫)引起的侵袭性真菌感染。目前,还没有药物被批准用于预防这些病原体引起的感染,而且目前的预防方案通常需要多种抗真菌药物,存在安全性和耐受性方面的问题。
Cidara公司已计划在2019年第一季度启动预防性III期临床研究ReSPECT,评估rezafungin在接受异基因骨髓移植患者中预防侵袭性真菌感染的疗效和安全性。
QIDP认定意味着,在成功完成临床项目后,PLG0206将获得优先审查权。而快速通道地位旨在促进FDA和制药公司在药物开发上的沟通和协作。QIDP是2012年7月美国《FDA安全与创新法案》(FDA Safety and Innovation Act)下GIAN法案产生的新药特批通道,旨在激励抗生素研发,以应对严重威胁生命的细菌感染。简单地说,QIDP=研究阶段快速通道(fast track)+审批阶段优先审评(priority review)+上市后5年额外市场独占权。
-
企业风采

-
焦点事件

-
企业风采

-
产品技术

-
焦点事件
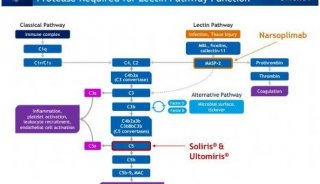
-
产品技术

-
产品技术

-
项目成果

-
焦点事件
-
焦点事件