手性分子合成救星——不对称催化
2021年度诺贝尔化学奖被授予德国有机化学家利斯特和美国有机化学家麦克米伦,以表彰他们在“发展不对称有机催化”方面做出的卓越贡献。不对称有机催化深刻地影响了药物研究:它简化了药物合成中的环节、降低了能源消耗,使化学合成更简捷、环保、经济。

我们的生活和工业生产都离不开各种化学合成产品,催化剂是化学家用来合成各种化学产品的基本工具之一,它可以用来调控化学反应速率,让反应变得更高效、能源消耗更低,从而降低生产成本。但长期以来,在手性化学品合成中主要有两大类催化剂可用:金属和酶。
有机催化剂,作为第三类手性催化剂,是一类基于有机小分子的催化剂。利斯特和麦克米伦在2000年左右各自报道了使用有机催化剂催化不对称反应。有机催化剂的有效性表现在它能够发挥不对称催化作用,可以驱动很多化学反应,从而被用来有效地合成手性化合物。在构建手性化合物时,会产生两种互为镜像结构的分子,就像我们的左右手一样,但是我们往往只需要其中一种手性分子,尤其在生产药品时,这就需要进行不对称催化合成。不对称有机催化将分子构造带到了一个全新的水平,它不仅使化学变得更加绿色,而且使生产手性分子变得更加容易。
大自然对左右的偏爱——手性
手性现象广泛存在于大自然中,巴斯德曾说:“生命向我们显示的乃是宇宙不对称的功能。宇宙是不对称的,生命受不对称作用支配。”大自然或许对左右是有所偏好的。宏观上,大到宇宙星系的运转,小到牵牛花的生长、蜗牛壳的螺纹,都有其特定的方向,例如太阳自转是左旋的;牵牛花的藤生长总是向左缠绕而上;蜗牛壳的螺纹多为右旋。微观层面上,生命体中的手性氨基酸全部是左旋的,生命的遗传分子DNA也大多以右旋形式存在。
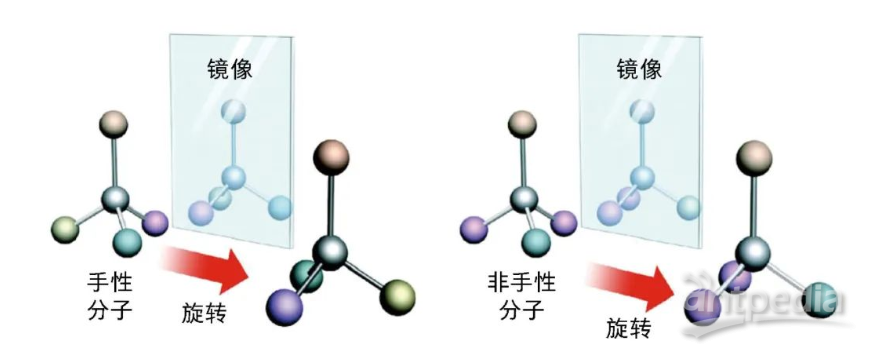
手性分子和非手性分子 手性分子无法通过旋转等对称操作,产生与其镜像相同的结构;而非手性分子通过旋转对称操作,可以产生与其镜像完全相同的结构。
“手性(chiral,chirality)”一词源于希腊语“cheir”,其原意为手,它是自然界中的基本属性之一,就像我们的左手和右手,看似一样,实则不同,它们互为镜像但相互不能重合。当一个分子与其镜像结构不能完全重合时,我们称其具有手性,它与镜像之间互为对映关系,称为对映异构体。对映异构体虽然在结构上差别微小,但往往表现出截然不同的性质,例如左旋天冬酰胺有甜味,而右旋天冬酰胺则是苦的;右旋柠檬烯有清新甜美的柑橘味,而左旋柠檬烯却有刺鼻的柠檬味。1960年代发生在欧洲的“反应停”(沙利度胺,thalidomide)事件,就非常典型地说明了各对映异构体会表现出不同的生理活性。沙利度胺曾用于抑制妊娠反应,但是在该药问世后的短短几年内,全球竟出现了近万例海豹肢畸形婴儿。研究表明,右旋沙利度胺具有镇静效果,能在妇女妊娠期用于控制精神紧张,防止孕妇恶心,且有安眠作用;而左旋沙利度胺却有致畸作用。当时市面所售的沙利度胺是两种构型手性分子的混合物,其中左旋构型分子的不良反应导致了悲剧的发生。该事件之后,在新型药物分子研发过程中,如果分子内存在手性中心,必须研究各对映体在人体内的生理活性和毒性的差别。在申请含有手性分子的药物上市时,必须确定其分子的绝对构型。因此,合成单一对映体的手性化合物对于生物医药、农药、功能材料以及手性化学品合成等方面极为重要。

向左缠绕的牵牛花藤

右旋的蜗牛壳螺纹
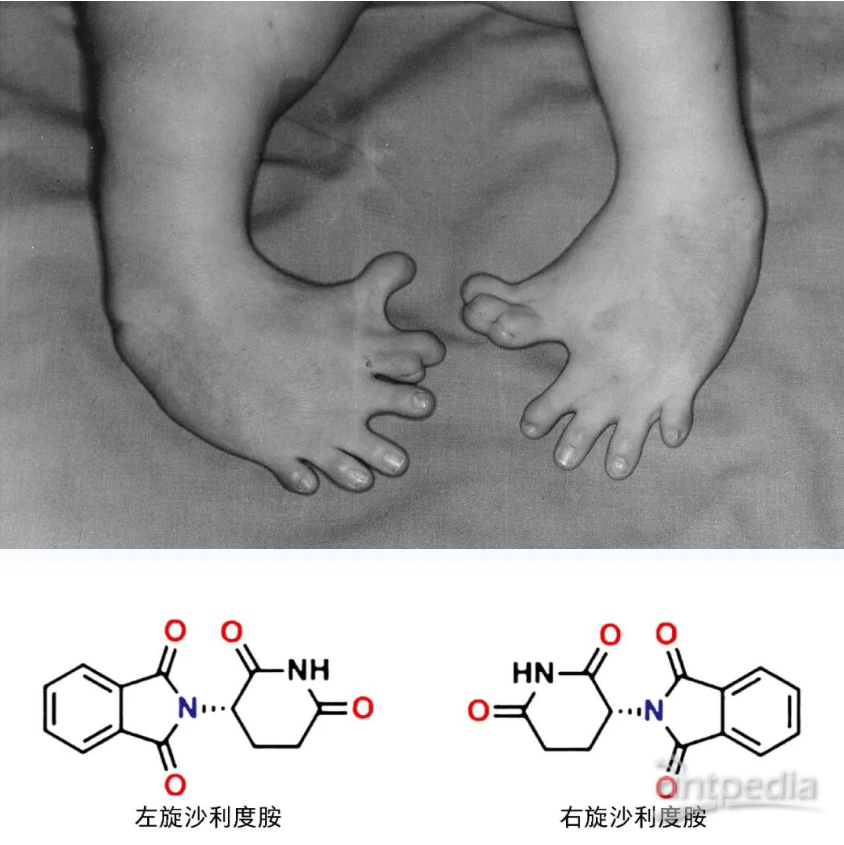
“反应停”药物事件 左旋沙利度胺的致畸作用导致产生手脚异常的畸形婴儿,右旋沙利度胺具有镇静作用。
手性分子合成的“引路人”——手性催化剂
传统合成手性化合物需要通过手性拆分得到单一手性分子,这通常是一项费时费“能”的过程。不对称合成的快速发展使手性化合物合成更加经济环保。不对称合成大致分为四类:手性底物诱导、手性辅基、手性试剂,以及手性催化,其中前三种方法都需要使用大量的对映纯化合物,而在手性催化中,仅需使用少量手性催化剂便可实现不对称合成。手性催化剂就像“引路人”一样,引导反应向着其中一条路径发生,生成特定预期的手性分子。因此,发展高效、绿色环保的手性催化剂成为不对称合成的核心关键。
在不对称催化合成中,目前常用的催化剂有三种:过渡金属配合物,酶和有机小分子。金属催化的成果和酶催化的成果已分别在2001年和2018年获得诺贝尔化学奖。酶催化剂具有高效的催化能力及单一选择性,但是催化条件有限且底物范围相对单一。金属催化剂具有用量少、催化效率高等优势,其研究最为深入,应用也最为广泛,但也存在产物中可能会有重金属残留的缺点。相较之下,有机小分子催化更加绿色经济,可促进绿色化学及制药业的发展,但不足之处在于催化剂通常用量大,反应模式单一等。这三类催化剂虽各有利弊,但相辅相成,是不对称催化领域的三种主要催化模式。不对称有机催化在2000年以后得到了快速的发展。
不对称有机催化的前世今生
不对称有机小分子催化,简称“不对称有机催化”,是指通过有机小分子化合物催化的不对称反应,它是一类基于模拟生物酶的非金属催化反应。早在1912年就有学者提出该设想,并在醛的羟氰化反应中进行了尝试,但结果并不理想,仅以不到10%的对映体过量获得预期产物(对映体过量表示一种对映体对另一种对映体的过量值,常用百分比来表示)[1]。虽然早期这类反应存在很大的局限性,但其重要性已初露头角。1960年,普拉塞尤斯(H. Pracejus)使用金鸡纳碱衍生物催化醇对烯酮类化合物的加成反应,获得了74%对映体过量产物 [2]。1970年代,维歇特(R. Wiechert)和哈约什(Z. G. Hajos)分别报道了使用手性脯氨酸催化分子内不对称羟醛缩合反应 [3]。可是这一成果当时并没有引起化学家们足够的重视,对其反应机理也没有进行深入研究,脯氨酸催化剂从此被束之高阁。1979年,井上章平(S. Inoue)利用手性小分子多肽催化氢氰酸和醛的加成反应,产物对映体过量值高达97% [4]。1984年,多林(Ulf. H Dolling)使用金鸡钠碱衍生的季铵盐成功催化了茚酮衍生物的甲基化反应,该研究为不对称相转移催化反应奠定了基础 [5]。氢键催化方面,多人分别报道了通过不对称斯特雷克(Strecker)反应合成手性α-氨基酸。此外,小分子手性肽、路易斯碱等有机催化也被相继报道。在这一领域,中国学者也做出了开创性的工作。1996年,杨丹和史一安分别使用联萘骨架和果糖衍生的手性酮类化合物作为催化剂,实现了高对映选择性烯烃的不对称环氧化反应,其中“史氏环氧化反应”成为国际公认的人名反应 [6]。次年,张绪穆使用刚性的手性膦催化联烯酸酯参与的不对称[3+2]环加成反应(该消旋反应最早由陆熙炎报道,在国际上被广泛称为陆氏反应),有效实现了该反应的区域选择性和立体选择性控制 [7]。邓力致力于氢键及路易斯碱催化不对称反应,设计合成了新型手性有机催化剂并应用于不对称反应中 [8]。尽管如此,有机催化并未形成系统且广泛认可的催化体系。直到2000年左右,利斯特和麦克米伦突破性的进展,将不对称有机催化推向了高潮且进入其黄金发展期。
利斯特最初的研究方向为酶催化有机分子合成,酶分子通常由多个氨基酸构成,而起实质催化作用的往往是酶分子中某一个或几个特定氨基酸。因此,他试图使用有机小分子来模拟酶,于是他将手性有机小分子代替比较复杂的生物酶催化剂,实现了手性脯氨酸催化分子间不对称羟醛缩合反应,产物对映体过量值高达96% [9]。利斯特提出的烯胺活化催化机理也被广泛认可,随后该催化体系被应用于其他不对称反应中,如曼尼希(Mannich)反应和迈克尔(Michael)加成反应等。已故的巴尔巴斯三世(C. F. Barbas Ⅲ)在这一工作中也做出了突出贡献。
与此同时,麦克米伦报道了手性咪唑烷酮催化不饱和醛与双烯分子间不对称狄尔斯—阿尔德(Diels-Alder)反应 [10]。麦克米伦提出了亚铵正离子催化模式,不饱和醛与手性二级胺发生反应,形成亚铵正离子中间体,随后与双烯体发生狄尔斯—阿尔德反应,最后亚铵水解,催化剂被释放,完成催化循环。值得一提的是,麦克米伦提出了有机催化(organocatalysis)这一术语,并被广泛应用。
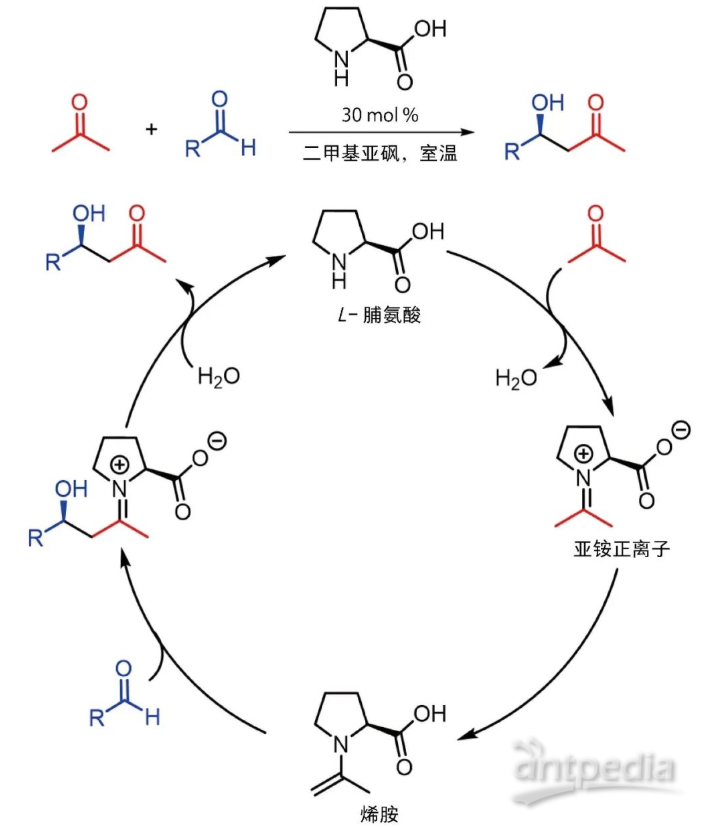
L-脯氨酸催化分子间不对称羟醛缩合反应

手性咪唑烷酮催化不对称狄尔斯—阿尔德反应
(Me为甲基,Ph为苯基)
利斯特和麦克米伦这两项基于手性二级胺催化的研究,引起了化学工作者的广泛关注。此后,该领域的发展日新月异,一系列新型的有机催化剂被研究报道,如手性胺、手性磷酸、手性氮杂环卡宾、手性相转移催化剂、金鸡纳碱衍生手性催化剂,以及手性路易斯碱等。有机催化也逐渐成为继金属催化和酶催化以后的第三种催化方法。
不对称有机催化反应中,催化剂一般不含金属,可以有效避开手性产物中残留重金属毒性的问题。与此同时,有机小分子催化剂一般对空气和水是稳定的,易于制备和贮存,其催化反应条件相对温和,不需要无水无氧操作,这一优势使其应用变得更加方便简捷。此外,有机小分子催化剂成本一般较低,是一类能源节约型、环境友好型的催化剂,对绿色化学和药物合成的发展至关重要。例如在合成治疗青光眼的药物PGF2α中,阿加瓦尔(V. K. Aggarwal)运用手性脯氨酸催化的不对称羟醛缩合反应得到关键中间体,将原本冗杂的合成路线缩短为7步,实现了高效经济合成。按照催化剂与原料的结合方式区分,有机催化反应的机理主要分为共价键催化和非共价键催化。共价键催化的机理包括手性胺催化,生成烯胺或亚铵正离子中间体,麦克米伦还发展了自由基亚铵正离子中间体活化模式。非共价键催化的机理是通过氢键或离子对的相互作用,更接近于大多数酶催化反应的模式,这为许多有机催化反应提供了合理的解释。随着对催化机理的深入研究,合成效率也得以提升,最终将会对手性化学品、药物、材料、农药等工业化应用产生巨大影响。
我国不对称有机催化的发展与现状
在过去几十年里,我国的化学基础研究得到了长足发展。尤其在不对称有机催化方面,取得了一系列具原创性、突破性和系统性的研究成果。我国学者在手性胺催化、手性磷酸催化、手性氮杂环卡宾催化、氢键催化、手性路易斯碱催化、手性醛催化等方面做出了一系列突出贡献。并致力于设计合成新型催化剂、探索高效反应催化体系、聚焦反应催化机制研究、推动工业化生产应用。例如,在手性胺催化方面,龚流柱合成了手性脯氨酸酰胺及其衍生物催化剂,程津培与罗三中发展了新型离子液型催化剂及手性伯胺催化剂,均被成功应用于不对称有机催化反应,取得了优异的成果。许鹏飞、肖文精、王卫与钟国富发展了一系列高效、高立体选择性串联反应。陈应春在新型有机催化剂合成和创新三烯胺催化机制方面做出了引领性工作。
与此同时,我国学者将理论基础研究引入工业化生产,为企业带来更加绿色环保、高效低能的先进技术,促进了药物合成与绿色合成的发展。例如马大为在基于有机小分子催化迈克尔加成反应的研究基础上,实现了7步合成抗流感药物达菲,大大降低了生产成本,提高了生产效率。张万斌在合成抗病毒药物瑞德西韦的过程中,巧妙使用了有机催化反应作为关键步骤,实现了该手性药物分子的高效不对称合成。值得一提的是,该反应催化剂经改造后可用于治疗丙肝药物分子MK-3682的不对称合成。
总之,在不对称有机催化黄金发展的20多年里,我国化学科研工作者逐渐在国际学术圈拥有愈来愈大的话语权,在某些领域起到了引领作用。
展 望
不对称有机催化发展至今,已形成了一套较为完善的理论基础和实践经验。多种类型的有机小分子催化剂被设计合成且应用于各种不对称催化反应,反应机理被深入研究并得到广泛认可,部分理论研究实现了工业化应用。然而,目前这一领域仍存在诸多问题与挑战:催化效率相对较低,往往需要较大的催化剂用量,增加了反应成本及后续纯化的难度。与金属催化相比,其催化体系及反应类型有限,限制了不对称有机催化的应用。发展手性有机催化新的活化模式、催化剂和反应,将有机催化与金属催化和酶催化相结合,融合光电催化等新技术将是未来的研究趋势。
长期被戏称为“理综奖”的诺贝尔化学奖,今年授予了两位有机合成化学家,这是对不对称有机催化领域涌现的学术成果与潜在应用价值的肯定,也是对化学基础研究工作者的鼓励。必将极大地推进不对称有机催化以及整个手性合成领域的发展,期待我国有更多的科研工作者投身这一重要研究领域,共同推动中国科学在不对称有机催化领域的发展,并为人类明天更加美好的生活带来福祉。