分子对接技术研究D715-2441 抑制剂与PB2蛋白的结合模式 二
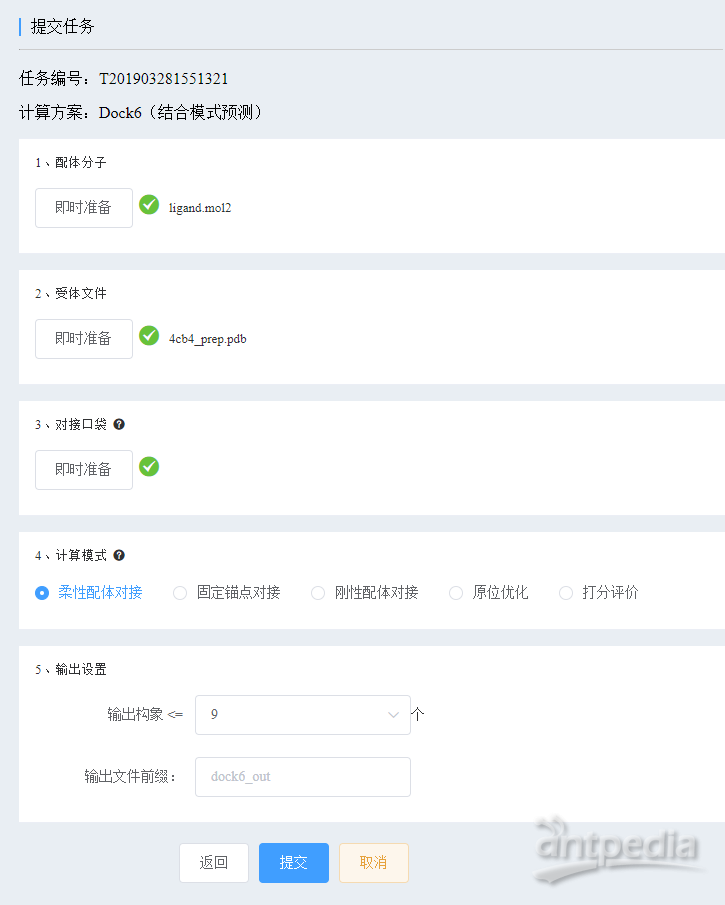
6、 提交计算任务
Dock6方案为我们提供了多种对接计算模式,这里稍微解释一下。
在各种模式中,蛋白受体都是刚性不动的。因为Dock6的Grid算法实际上并非直接采用蛋白结构进行对接,而是采用其模型(正是前面生成的格点)。根据配体运动的方式,分为下面几种情况:
1) 柔性配体对接,即配体在对接过程中是柔性可变的,可旋转单双键产生不同构象。这是最常用的默认的模式;
2) 固定锚点对接,即在口袋中对配体进行小范围构象搜索,配体有一块结构(通常为最大的刚性结构)看似被固定住,而其他部分则可变动。该模式的用处是,在保持配体整体结合位置不变的情况下,寻找更好的结合模式;
3) 刚性配体对接,即配体是刚性的,不能旋转化学键,仅可整体平移和翻转。可能的使用场景是,配体的构象具有某种特殊意义,希望对接后保持不变,或者评估蛋白是否能够容纳这种构象;
4) 原位优化(in-situ minimization),即在口袋中对配体分子进行能量优化,不进行构象搜索。可用于优化配体的结合模式;
5) 打分评价,即对口袋中的配体分子进行打分评价,不进行构象搜索。可采用不同打分函数对配体某一结合模式进行重打分。
我们采用柔性配体对接模式,其他参数采用默认值,然后提交任务。
7、 对接结果分析
1) 查看对接打分
Dock6方案的对接总打分是Grid Score,负值表示有结合,正值表示不结合,因此,打分值越小(负值的绝对值越大)表示结合力越强。它与另外两项能量项——范德华力和静电力——的关系是:Grid Score = Grid_vdw + Grid_es。Internal Energy是分子内能,表示对接构象(pose)的张力大小,正值,越小越好,通常20 kcal/mol以下比较合理。Pose列是对接构象编号,按照Grid Score从小到大排列。因此,第一个pose即为对接软件根据打分判断为最好的对接构象。
根据经验,Grid Score>-40 kcal/mol属于结合力较差,-40~-50kcal/mol属于中等,<-50kcal/mol属于较好。由于D715-2441分子较小,所以疏水作用面积小,范德华力贡献自然较小,静电力贡献通常也不会很大,导致整体打分较差。这是可以理解的,也应理解为该对接构象还算合理。
从打分分布看,各个pose的打分相差不大,范德华力贡献为主,第一个pose的静电力贡献相对其他pose出奇地大,意味着它具有较多较强的静电作用力(比如氢键和盐桥)。

2) 分析相互作用
仔细观察各个pose,结合上面的对接打分。我们认为第一个pose 的作用力最多,结合力最好,结合方式符合预期,是最好的构象。对比文献,这个pose与之几乎完全一致(下面会解释差异之处)。因此,我们选择它来做结合模式分析。
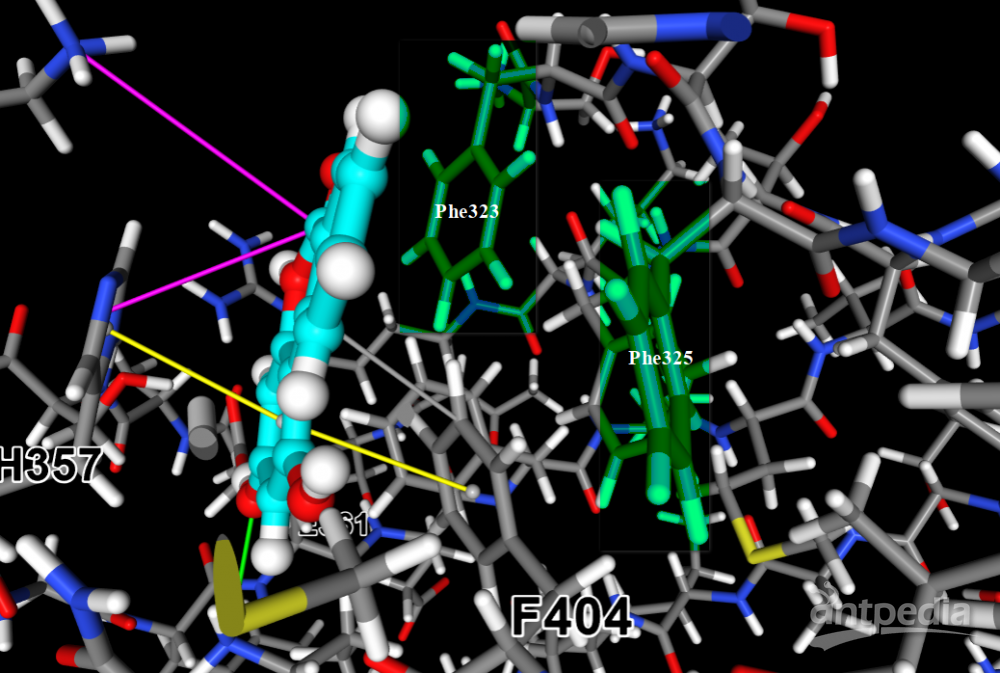
为清晰起见,点击视图右侧Protein下的cartoon按钮,去掉cartoon样式。点击Ligand下的center按钮,居中显示配体。我们清晰地看到,化合物D715-2441的芳环结构夹在H357的咪唑环和F404的苯环之间形成三明治结构,并与之分别形成π-π堆积作用(黄线),还有与F404的疏水作用(灰线),这些作用力一起构成了范德华力,提供了约-35.48kcal/mol的结合力贡献。另一方面,E361的羧基和K376的质子化N原子同时与苯环上的羟基形成氢键,氢键距离、角度可从下方表格查到。F404骨架上的氧原子也与D715-2441另一个羟基形成氢键作用。与文献不同的是,K339的N+原子和H357的咪唑基都跟环酯基形成盐桥作用。这种作用通常认为是非典型的,所以文献未提及,但在我们的检测分析工具里,它被呈现出来。这些极性作用为化合物的结合提供了较强的静电力贡献(约-7.69kal/mol),这也是该pose相对其他pose而言静电力非常显著的原因。

跟文献存在差异的另一个地方是,文献显示Phe323与化合物存在π-π堆积作用,Phe325存在疏水作用。但在我们的分析结果中,并没有出现这两个作用力。实际上,这两个氨基酸残基距离底物稍远,刚好超过该分析工具的相互作用力几何判断标准。但若将其原子结构显示出来,即发现也在附近(下图)。在柔性配体对接模式下,蛋白是刚性的,蛋白口袋的形状、残基位置未必是与配体最契合的。普遍认为,蛋白-配体之间存在“诱导契合”效应。在真实情况下,由于分子热运动,蛋白、配体间距离不可能一成不变。对接计算只是展示了其静态的一面,在真实世界里,几何距离在临界点附近的作用力可能“若隐若现”。