答疑解惑专题(二)——代谢组学粪便样本收集

点击上方蓝字,关注麦特绘谱
今天,小编要给大家分享一篇有“味道”的推文。俗话说:“病从口入,祸从口出”,小编曾不以为然。现如今越来越多有关肠道菌群的研究报道,让小编不禁感叹古人的智慧。这些寄生于人类肠道的微生物几乎和人类所有疾病都有关联。肠道菌群与宿主相互发生代谢作用并产生许多重要的信号因子和代谢底物,如三甲胺-N-氧化物、支链氨基酸、短链脂肪酸和胆汁酸可对诸多疾病的发生发展产生影响。粪便是肠道菌群和宿主互作的终端,具有无创、易于获得特点,常被选择用于菌群相关代谢物的检测。那么对于粪便样本,我们究竟该如何进行采集呢?大鼠粪便收集较为方便,直接取2-3粒,而小鼠粪便小,需要收集≥5粒,收集的新鲜粪便置于灭菌离心管中,再冻存于-80℃冰箱。对于人类粪便样本,面对着一坨散发着异味的排泄物,我们该从何处下手呢?不用担心,已有勇士替我们测试出了较优的应对策略,且让小编一一道来。
从下图中可以看出[1],粪便收集器中不同位置取出的局部粪便样品和整体匀浆后的粪便样本(绿色)在PCA得分图上有较为明显的分布差异,且这种差异在不同个体之间是不一致的。相比于代谢物组,不同位置获得的菌群测序结果却差异不明显,为了方便存储,显然不可能把所有收集到的新鲜粪便冻存。因此,临床上冻存收集的新鲜粪便之前,需用无菌棒将样品混匀。

图1. 粪便不同部位代谢轮廓PCA图,来源文献[1]。
临床上收集粪便样本,可能会碰到病人在自己家中采集粪便的情况。此时,如何将粪便运送至医院是需要考虑的事情。如下图所示,相比于5h、10h和24h,粪便在室温和冷藏条件下放置1h,其代谢轮廓与新鲜粪便更为接近。但单独比较新鲜粪便和放置1h后的粪便时可发现,室温可致乙酸和戊酸含量显著升高,而琥珀酸和富马酸含量显著降低。冷藏存储则较为稳定,其代谢物和新鲜粪便无明显差异[1]。因此,患者在家中采集的新鲜粪便需置于冰上,并在1-2小时之内送至医院。

图2. 室温和冷藏不同时间的PCA图,来源文献[1]。
除了直接冻存收集的新鲜粪便,另一种方式是按1:2(粪便:水)或其他比例加入水或PBS,振荡后,超速离心获得粪水,以粪水的形式存储。如下图所示,新鲜粪便在-20℃放置1h后,代谢轮廓即发生了较为明显的改变[1] 。冻存24h后粪水的代谢轮廓更稳定,和新鲜粪水没有明显差异,但粪水在室温下放置5h及冷藏下放置24h以上,代谢轮廓开始明显偏移[1]。需要指出的是,粪水样品对于检测疏水性强的化合物并不适合。另外,冻干粪便也是一种选择。一般200mg的新鲜粪便可获得约40mg的冻干粪便[2]。Lee等[3]对比了粪水和冻干粪便的差异,发现粪水中疏水性的长链醇、酯和甾醇类损失明显。冻干粪便亦有缺点,即冻干的过程会损失挥发性的代谢物,如SCFAs[4]。

图3.不同温度和时间存储粪便和粪水样本的PCA图,来源文献[1]。
如下图所示,冻融两次和三次的粪水样本和新鲜粪水样本在PCA图上存在明显区分,且可以分别和新鲜粪水样本建立稳健的OPLS-DA模型。反复冻融对氨基酸和尿苷有显著影响[1]。因此,粪便样本应当提前分装,避免反复冻融。
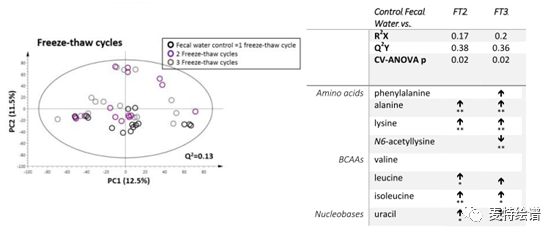
图4.不同冻融次数粪水样本的PCA图和差异代谢物,来源文献[1]。
肠道内容物
粪便反映的是整个肠道和宿主互作的最终结果,无法真实反映各个肠段的菌群活动。菌群分泌的某些代谢物可能只是作为“中间产物”会被宿主重新吸收加以利用,所以代谢物在各肠段的分布不尽相同。以胆汁酸为例,十二指肠和回肠中的胆汁酸以结合型胆汁酸为主,丰度分别可达97.8%和89.7%,而盲肠和直肠中以非结合型胆汁酸为主,丰度分别可达97.7%和97.5%[5]。因此,肠道内容物与粪便样本相结合,能让我们更全面地研究菌群和宿主之间互作的代谢关系。对于动物模型,肠道内容物易于获得,常被用于菌群代谢物的检测。菌群测序结果也显示粪便和各肠断的微生物相似度为0.7-0.9,并不能完全代表宿主各肠段微生物的真实情况[6]。
以各肠段名及粪便分别和16S作为关键词在Pubmed数据库上检索近五年的文章,搜索结果如下图所示。可以看出测序样本以粪便为主,肠道内容物则以结肠和盲肠为主,可能是因为结肠中微生物数量最为丰富,而盲肠因为相对封闭的环境,菌群较为稳定。代谢组学和测序是研究肠道菌群的两大利器,常被结合使用。因此,我们可以选择同一种样本,对菌群测序结果和代谢组学结果作关联分析,以深入挖掘菌群—宿主的互作机制。

图5. 近五年肠道内容物测序文章数量,数据来源Pubmed。
粪便样本虽然无创易得,但基质复杂,我们需要尽量减少样本收集、存储和分析中引入的误差。
对于粪便样本的收集,我们需要注意以下几点:
(1)原始新鲜粪便需要混匀;
(2)如在家中收集,样本应置于冰上并在1-2h之内送至医院进行后续处理;
(3)粪便可以粪水结合粪便或冻干粪便的形式存储;
(4)提前分装,避免反复冻融。
对于动物实验,肠道内容物也是检测菌群代谢物的首选样本之一,目前研究较多的是结肠和盲肠。我们可以选择同一种肠道内容物,结合测序数据,作关联分析。

1.Gratton, J., et al., Optimized Sample Handling Strategy for Metabolic Profiling of Human Feces. Anal Chem, 2016. 88(9):4661-8.
2.Ng, J.S., et al., Development of an untargeted metabolomics method for the analysis of human faecal samples using Cryptosporidium-infected samples. Mol Biochem Parasitol, 2012. 185(2):145-50.
3.Phua, L.C., et al., Global gas chromatography/time-of-flight mass spectrometry (GC/TOFMS)-based metabonomic profiling of lyophilized human feces. Journal of Chromatography B, 2013. 937:103-113.
4.Saric, J., et al., Species variation in the fecal metabolome gives insight into differential gastrointestinal function. Journal of Proteome Research, 2008. 7:352-360.
5.Xie, G., et al., Alteration of bile acid metabolism in the rat induced by chronic ethanol consumption. Faseb J, 2013. 27(9):3583-93.
6.Wen-jing, Z., et al., Metagenomic Sequencing of Gut Microbiota along the Intestinal Tracts and Feces in Mice. Journal of Shanghai Jiaotong University(Agricultural Science), 2016. 3:15-21.




长
按
关
注
解锁更多更精彩的「代谢组学」相关资讯!
微信公众号:麦特绘谱
Tel:400-867-2686
Web: www.metaboprofile.com
-
仪器推荐
-
仪器推荐

-
仪器推荐
-
仪器推荐

-
仪器推荐
-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章