Cell | 蛋白基因组学揭示胰腺癌潜在治疗靶点与早期诊断标志

景杰学术 | 报道
胰腺导管腺癌(PDAC)是一种致命的恶性肿瘤,早期检出率低,侵袭性高且预后不良 [1 ]。目前主要的治疗方案——细胞毒性药物的疗效有限,且有严重的副作用,突出了尽早开发更有效、耐受性更好的治疗方法的必要性。KRAS驱动突变的肿瘤难以通过药物靶向,因此,PDAC的早期诊断和合适靶点的确定仍然具有极大地挑战性和广阔的应用前景。


为了研究PDAC的蛋白质基因组特征,研究人员收集了140例胰腺肿瘤、67对癌旁组织(NATs)和9例正常胰管组织样本(样本策略),进行了全外显子组测序(WES)、全基因组测序 (WGS)、RNA测序(RNA-seq)、microRNA测序(miRNA-seq)、DNA甲基化组、TMT蛋白质组、磷酸化蛋白质组和糖蛋白质组并产生了八组组学数据(图1A)。该研究着重比较了不同国家、癌症分期、肿瘤部位和健康状况的患者样本,以确保高质量的PTM蛋白分析 (图1B)。并根据KRAS VAF、CNVs等标准鉴定了105个高肿瘤纯度样本 (图1 C-D)用于后续的多组学分析。

图1 PDAC队列的蛋白质基因组景观
在105个高肿瘤纯度组织样本中,发现胰腺癌驱动基因KRAS、TP53、CDKN2A和SMAD4的体细胞基因组有大幅改变 (图2A)。研究者用STAR方法全面描述了基因改变对相应基因产物或其他相互作用基因的RNA、蛋白质和磷酸水平的影响 (图2B-C)。发现TP53的改变在蛋白质和磷酸水平上具有最多的反式效应,在RNA/蛋白质水平和磷酸水平上识别出不同的靶点,推测可能是由于广泛的翻译后调控导致的。有趣的是,TP53突变与DNA损伤修复途径 (如MSH6、TP53和TP53BP1) 中蛋白磷酸化的增加相关,这表明这些改变在维持基因组完整性和防止细胞凋亡方面发挥了作用 (图2C)。研究人员还鉴定了几个臂级和焦点级CNV (图2D-E) 的基因、蛋白质和磷蛋白表达水平改变,并将重点放在了在扩增基因座中新的CNV驱动因子的识别 (图2E-F)。在543个扩增峰内的基因中,165个拷贝数与相应RNA水平显著相关,其中23个蛋白表达一致 (图2F)。通过这种方法识别的蛋白与肌动蛋白纤维和细胞骨架重组相关 (图2F和2G),参与肿瘤发生和转移。

图2 基因组改变对转录组、蛋白质组和磷蛋白质组的影响
PDAC肿瘤由于诊断率低,导致预后不良,因此,用于早期检测的生物标志物可能提高患者生存率。研究人员对肿瘤中异常调节的蛋白质、磷酸化位点和糖基化位点进行检测,发现相对于NATs,PDACs中分别有2218和2244个蛋白显著下调和上调 (图3A)。随后,研究人员对其中222个PDAC相关蛋白质进行深入研究,发现相比正常导管或NATs,有21种相关蛋白显著上调,且这些蛋白在PDAC早期阶段同样上调 (图3B)。特别是,其中12种是分泌蛋白,可以作为血清或胰液中的早期检测标志物。
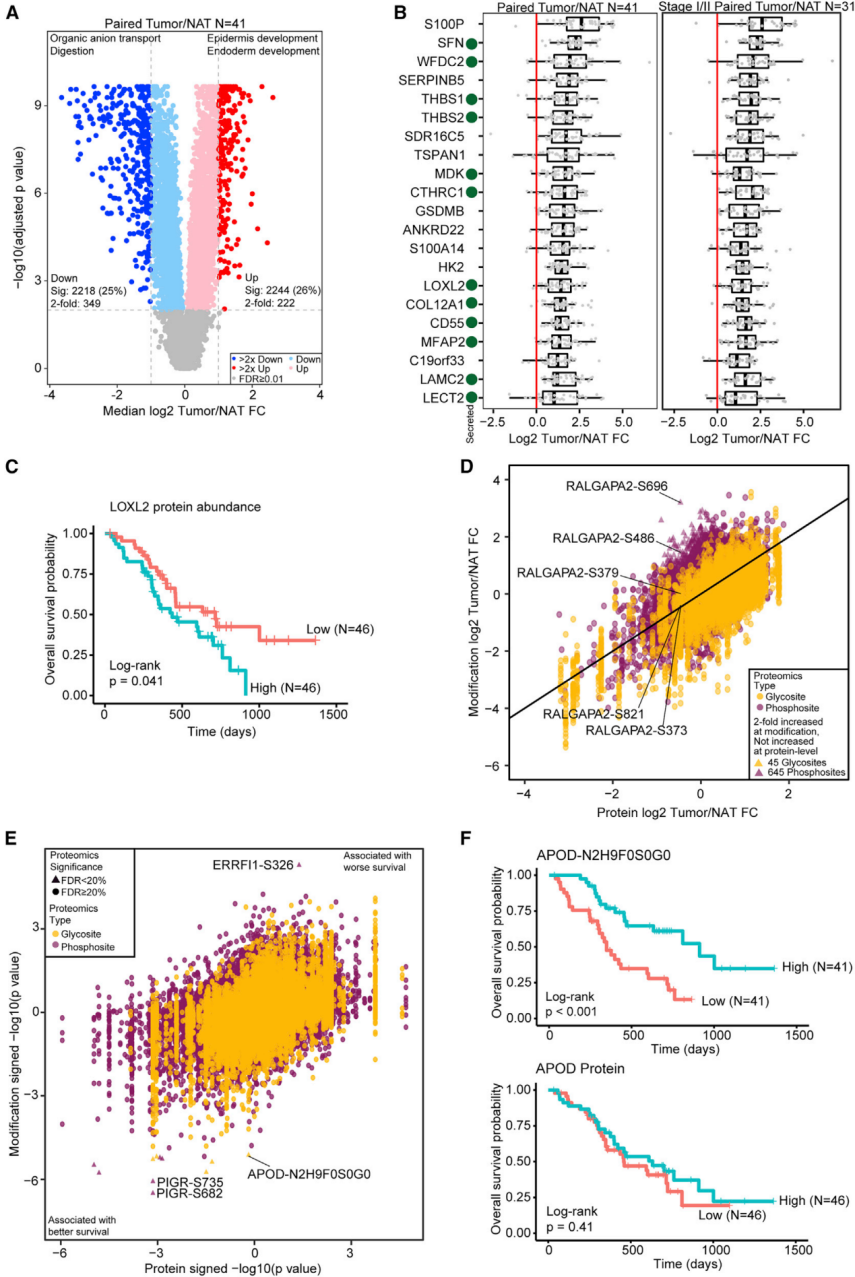
图3 PDACs/NATs肿瘤相关蛋白和修饰位点的鉴定
大多数糖蛋白是膜结合蛋白或分泌蛋白,因此可以作为免疫治疗和疾病检测的潜在靶点来源。糖蛋白组学分析发现,相较于NATs,PDAC中有75个N-连接糖蛋白上调>2倍 (图4A)。研究者根据不同的KRAS突变热点进一步区分了肿瘤和正常导管的N-连接糖蛋白表达 (图4B),在KRAS G12D、G12V和Q61H突变的肿瘤中,PDAC患者的不良预后标志物CEACAM5和CEACAM6显著上调,而G12R突变样本中没有上调(图4B)。肿瘤中上调的N-连接糖蛋白主要通过含唾液酸和/或焦点的复杂聚糖修饰,下调的N-连接糖蛋白主要通过低甘露糖聚糖修饰 (图4C)。这些数据表明,聚焦PDAC中上调的N-连接糖蛋白的唾液酸化和/或岩藻糖基化多糖可能会增加癌症标志物的特异性。接下来,研究者根据糖基化生物合成酶的丰度水平研究了这些糖基化改变可能的内在机制 (图4D-E),发现唾液酸化和/或岩藻糖基化的IGPs与糖基化酶的表达正相关。这些数据表明,抑制相关糖基化酶活性可能会削弱大多数肿瘤中唾液酸化和/或岩藻糖基化多糖的上调,这是可能成为一种潜在的PDAC治疗策略。
 图4 糖蛋白组学鉴定早期检测或治疗干预潜在靶点
图4 糖蛋白组学鉴定早期检测或治疗干预潜在靶点由于KRAS驱动突变的肿瘤很难通过靶向疗法进行治疗,研究人员试通过研究被激活的KRAS下游的信号转导通路,以寻找替代的治疗靶点。通过对41对肿瘤/ NAT组织的磷酸肽的丰度差异分析,鉴定出了五种磷酸底物 (MAPK6, FLNA,BAD, MCM2和STAT3) 与对应激酶(CDK7, AKT1, PAK1, PAK2, and SRC) (图5A),并随后对激酶的差异表达模式进行分析 (图5D)。通过评估不同KRAS热点突变的肿瘤和相对NATs中磷酸盐的表达变化,研究人员进一步分类了19种激酶 (图5E),这些不同的激酶表达模式揭示了与特定KRAS突变相关的替代治疗靶点。
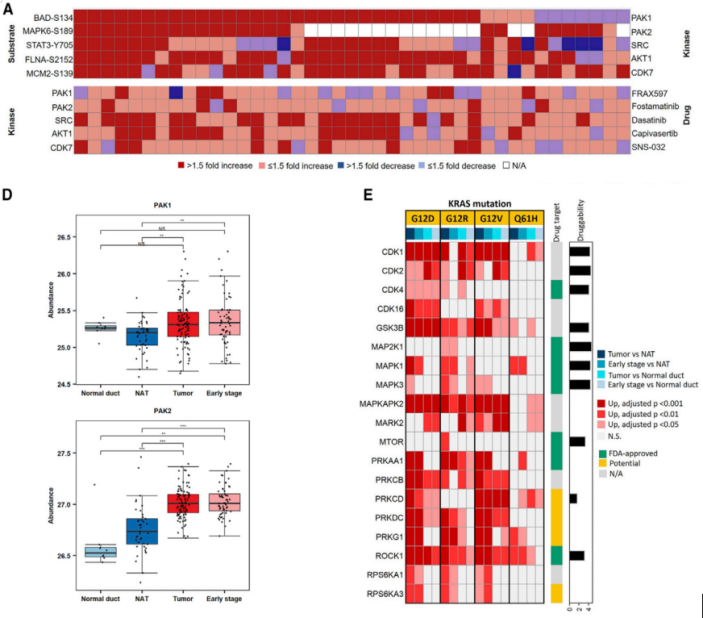
图5 激酶和底物共同调控

图6 PDAC细胞组成和免疫冷态PDAC的识别
总的来说,该研究比较了PDAC、NATs和正常导管组织在多个组学水平上独特的分子特征,使人们能够更深入地理解与PDAC相关的基因组畸变的功能后果,并为潜在的PDAC治疗靶点和早期诊断标志物的发现提供了丰富的生物信息源。值得一提的是,继磷酸化修饰、乙酰化修饰后,该研究首次将糖基化修饰组学引入大队列癌症蛋白基因组学的研究中,揭示了以糖蛋白生物合成为目标,有助于早期发现和治疗干预,为后续研究指明了新的方向。
更多阅读
Blood+/PRM2 | 血液蛋白质组从发现到验证的全流程升级

CTM | 复旦大学蔡加彬组报道组蛋白乙酰化或可作为肝癌预后潜在生物标志物

Cell|再添成果!蛋白组学研究发现肺鳞状细胞癌治疗的新靶点

致癌蛋白Girdin再添“罪证”,南京医科大学王芸组修饰组学揭示胰腺癌发生新机制

与“癌”共舞,Cell Reports:蛋白质组学助力解决KRAS靶向疗法耐药性困局

寻找阿喀琉斯之踵!Nature | 整合蛋白质组学研究揭示“癌症之王”治疗新靶点

参考文献:
1. Quante, A.S., et al., Projections of cancer incidence and cancer-related deaths in Germany by 2020 and 2030. Cancer Med, 2016. 5(9): p. 2649-56.
2. Liwei Cao., et al., Proteogenomic characterization of pancreatic ductal adenocarcinoma. Cell, 2021. 184(19): 5031-5052.
本文由景杰学术团队报道,欢迎转发到朋友圈。如有转载、投稿等其他合作需求,请文章下方留言,或添加微信ptm-market咨询。 #关注领取新人福利,下载最近三年影响因子(后台发送关键词“新人”)
#关注领取新人福利,下载最近三年影响因子(后台发送关键词“新人”)