天价CAR-T细胞治疗有啥副作用?
细胞治疗
顾名思义,是指利用活细胞进行治疗,也就是说,药是“活细胞”。CAR-T(Chimeric Antigen Receptor T-Cell)疗法,作为细胞治疗的一种,截至目前,全球共批准上市了 6 款 CAR-T 疗法产品,价格昂贵。那么,和其他药物一样,是否存在“副作用”,毕竟是药三分毒......今天,我们来浅谈CAR-T细胞治疗的副作用之一:细胞因子释放综合症(CRS:Cytokine Release Syndrome)。
CRS产生机制
细胞治疗过程中,改良后的CAR-T细胞,回输至人体,快速诱导免疫激活,高度增值的T细胞和各种促炎细胞因子的超生理水平诱发(包括IL-1、IL2、IL-6、IL15、IFN-γ、 TNFα,、 Angiopoietin 1&2和GM-CSF等等),可能会引起CRS,其发生率为42-100%,0-46%的患者在输注CAR-T细胞后出现严重的CRS。临床表现为发热,肌痛和乏力。并可发展为危及生命的休克,低氧和毛细血管渗漏。临床上对CRS的衡量,可采用实验室炎症标志物(C反应蛋白、铁蛋白等等)、儿茶酚胺和细胞因子等检测手段。
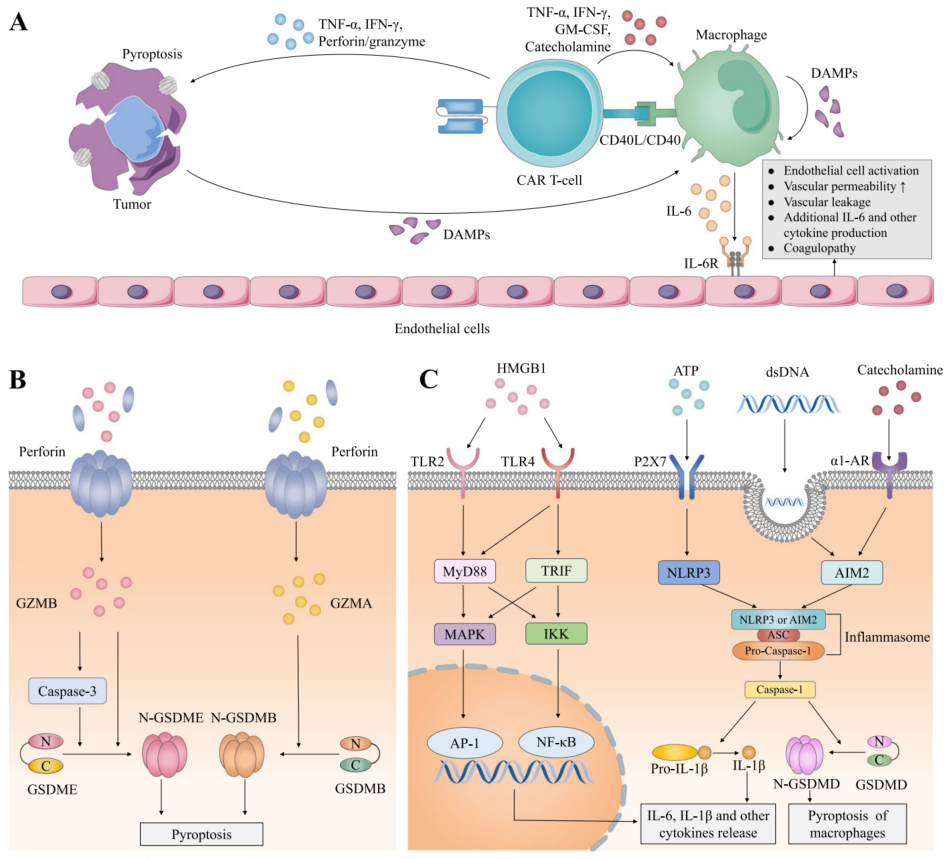
图1. CRS产生机制
CAR-T细胞的激活和靶细胞焦亡:根源因素
CAR-T细胞和肿瘤细胞相遇后,宿主旁观者细胞(例如,巨噬细胞)被激活,导致细胞因子稳态失衡。大量细胞因子引发内皮细胞激活,导致与CRS相关的全身症状。识别肿瘤抗原后,CAR-T细胞释放大量穿孔素/颗粒酶和细胞因子,包括TNF-α和IFN-γ,导致肿瘤细胞焦亡(Pyroptosis)。
肿瘤细胞焦亡与细胞凋亡(Apoptosis)不同,其特点是细胞肿胀、裂解和之后的细胞内容物与促炎症因子释放。细胞焦亡被视为CRS的开始,由颗粒酶B(GZMB)和颗粒酶A(GZMA)介导的两条通路可能参与其中。GZMA和GZMB都可以通过穿孔蛋白形成的孔隙进入细胞。随后,GZMB直接或通过激活Caspase-3裂解焦孔素E(Gasdermin E:GSDME)。GZMA直接裂解焦孔素B(Gasdermin B:GSDMB),使其活化。被C端掩盖的Gasdermin的N域可以被释放,并在细胞膜上寡聚形成孔隙,导致细胞活力下降,气泡从质膜吹出,细胞肿胀,最终导致细胞裂解。
巨噬细胞激活:关键调节
越来越多的研究表明,单核细胞和巨噬细胞是与CRS有关的炎症细胞因子的主要来源。巨噬细胞可被损伤相关分子模式(DAMPs)激活,包括,高迁移率族蛋白-1(HMGB1)、5′-三磷酸腺苷(ATP)和双链DNA(dsDNA)。它们是肿瘤细胞焦亡的产物。
HMGB1能与巨噬细胞表面的Toll样受体2(TLR2)和TLR4结合。之后,适配蛋白、骨髓分化出反应蛋白88(MyD88)和含TIR域的适配蛋白,诱导IFNβ(TRIF)招募,并激活丝裂原激活蛋白激酶(MAPKs)和IκB激酶(IKK)。MAPKs和IKK通过转录因子激活蛋白1(AP-1)和核因子κB(NF-κB)调节多种细胞因子的释放,包括IL-6和IL-1β。
ATP被巨噬细胞上的P2X7受体识别,可诱导细胞质中的NOD-、LRR-和Pyrin域蛋白3(NLRP3)激活,并招募与凋亡相关的斑点蛋白(ASC)和Pro-Caspase-1形成NLRP3 炎症小体,随后导致Caspase-1的成熟。一方面,Caspase-1负责pro-IL-1β裂解和IL-1β的分泌;另一方面,Caspase-1将焦孔素D活化,并导致巨噬细胞焦亡。焦化的巨噬细胞因此产生更多的DAMPs和促炎因子,形成恶性循环,导致巨噬细胞的进一步激活。
dsDNA介导的黑色素瘤2(AIM2)炎症小体通路缺失,可能参与了Caspase-1的形成。巨噬细胞吞噬由焦亡的肿瘤细胞释放出的dsDNA,并激活细胞质中的AIM2炎症小体,它是一个dsDNA传感器。与NLRP3炎症小体通路类似,激活的AIM2形成AIM2/ASC-Pro-Caspase-1复合物,触发Caspase-1依赖的IL-1β成熟,从而导致CRS加重。
除了 "焦亡-DAMPs-巨噬细胞 "模式外,巨噬细胞还可以被CAR-T细胞产生的细胞因子招募和激活,例如TNF-α、IL-2、GM-CSF和IFN-γ。CAR-T细胞和巨噬细胞之间的接触,CD40配体(CD40L)与CD40的相互作用,也可能在触发IL-6和IL-1的释放和诱导型一氧化氮合成酶(iNOS)的表达发挥作用。iNOS刺激 NO 的产生,导致血管扩张和血流动力学不稳定,这是CRS常见的临床表现之一。
另外,CAR-T细胞和恶性细胞共培养后会产生儿茶酚胺,也可能参与细胞因子的释放。通过结合巨噬细胞表面的α1-肾上腺素受体(AR),儿茶酚胺可以增强AIM2/ASC-Caspase-1途径,并进一步促进IL-1β的产生和巨噬细胞的焦化。此外,儿茶酚胺会在巨噬细胞中形成一个自我放大的前馈环路,进一步促进儿茶酚胺、IL-6和其他细胞因子的释放,包括巨噬细胞炎症蛋白(MIP)-1α、IFN-γ、IL-2和TNF。单核细胞也可能是CRS中IL-6和IL-1的关键介质和主要来源,曾有报道,在CAR-T细胞治疗前去除单核细胞,可以保护小鼠免受致命CRS的伤害。
IL-6和内皮细胞的激活:核心途径
在单核细胞/巨噬细胞释放的细胞因子中,包括IL-6、IL-1、IL-2、TNF-α、GM-CSF 和IFN-γ,IL-6起着核心作用。值得注意的是。除了巨噬细胞和单核细胞外,树突状细胞、内皮细胞,甚至是CAR-T细胞都被认为参与了IL-6的产生。IL-6主要通过与膜结合IL-6受体(mIL-6R)(经典信号传导)或sIL-6R(反式信号传导)和另一种膜蛋白gp130结合,来激活其下游的Janus激酶(JAK)、信号转导剂和转录激活剂3(STAT3)。gp130广泛表达,而mIL-6R主要在肝细胞和免疫细胞中表达。不表达mIL-6R的细胞,例如,内皮细胞,被反式信号传导激活,其中IL-6与sIL-6R结合并在血清中形成复合物,引发细胞膜上gp130的二聚化。
因此,被激活的内皮细胞会分泌额外的IL-6和其他促炎症因子,如血管内皮生长因子(VEGF)、IL-8、单核细胞趋化蛋白-1(MCP-1)和凝血酶原激活剂抑制剂-1(PAI-1),导致细胞因子释放和炎症反应放大的正向循环。
此外,内皮细胞会受到细胞因子损伤,导致血管通透性和渗漏增加、水肿、器官灌注不足、凝血病和器官功能障碍。
细胞因子检测
连续监测CAR-T细胞治疗输注前后,患者的细胞因子动态变化水平有什么重要意义呢?来自美国佛罗里达H. Lee Moffitt癌症中心的科学家,在一个由75名大B细胞淋巴瘤患者的队列中,确定使患者处于严重毒性或治疗相关死亡的高风险因素,这些患者均接受了CD19靶向CAR -T细胞产品(Yescarta:Axicabtagene Ciloleucel)的治疗。来自Kite Pharma的Yescartata已于2021年3月,被美国食品药品监督管理局(FDA)批准上市。
在清除淋巴细胞的化疗(Lymphodepleting Chemotherapy)前,CAR-T输注当天,以及患者住院期间每天测量血清细胞因子(GM-CSF, IL1β, IL2, IL6, IL15, IFNγ, TNFα, 和Angiopoietin 1&2均利用ProteinSimple品牌全自动ELISA检测平台Ella检出)和儿茶酚胺水平。

此处应有广告:我的英文名叫Ella,中文名叫全自动微流控ELISA检测平台,我来自ProteinSimple,我能解放你的双手,让你体会到什么叫“放纵的滋味”。我人如其名,用过的都“爱啦”。
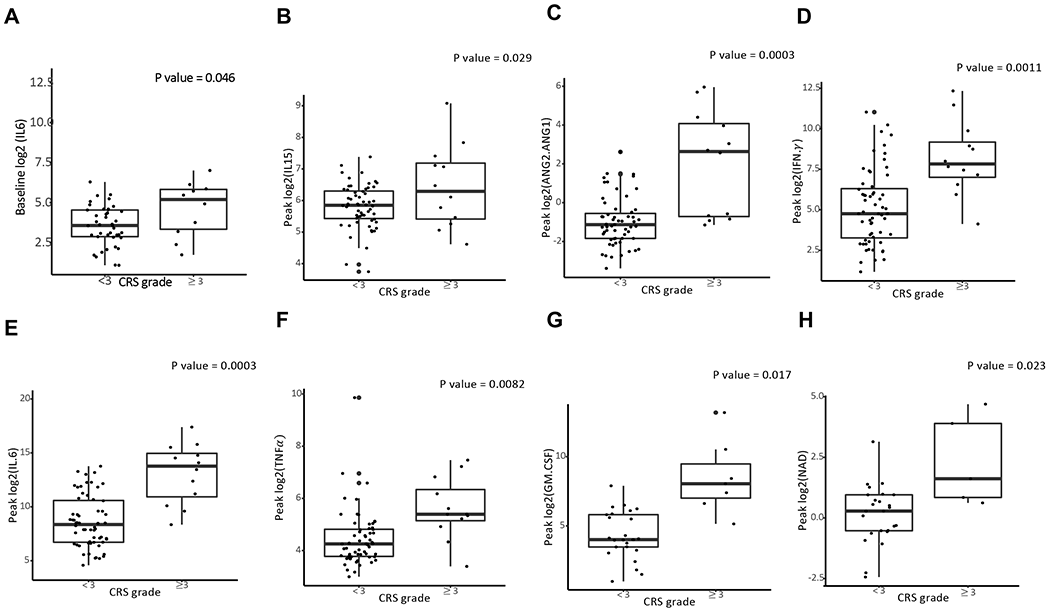
图2. 细胞因子检测
研究发现,治疗前的IL-6水平与危及生命的CRS之间存在关联。即促炎症状态和不利的肿瘤微环境(TME)预先使患者暴露在CAR-T细胞治疗后相关的免疫毒性风险中。需要根据患者的风险来制定毒性管理策略,从而降低发病率和死亡率。
正如本文通讯作者H. Lee Moffitt癌症中心医学主任Marco Davila博士所说,“在治疗前确定哪些患者在接受CAR-T细胞治疗后可能更容易出现严重的毒副作用,可以让我们更好地定制针对他们的治疗方案,以缓解或减少这些不良反应。”
因此,在深入了解CRS的发生机制,知道在CAR-T输注前IL-6水平与治疗后的免疫毒性高度相关,我们即可提前利用药物进行干预。例如,使用托珠单抗(抗IL-6R抗体)等药物阻断IL-6R,降低CAR-T治疗后的免疫毒性风险,将“副作用”扼杀在萌芽。

图3. 针对CAR-T相关毒性治疗方案
参考文献:
1. Faramand, Rawan et al. “Tumor Microenvironment Composition and Severe Cytokine Release Syndrome (CRS) Influence Toxicity in Patients with Large B-Cell Lymphoma Treated with Axicabtagene Ciloleucel.” Clinical Cancer Research, 2020.
2. Siegler, Elizabeth L, and Saad S Kenderian. “Neurotoxicity and Cytokine Release Syndrome After Chimeric Antigen Receptor T Cell Therapy: Insights Into Mechanisms and Novel Therapies.” Frontiers in Immunology, 2020.
3. Xiao, Xinyi et al. “Mechanisms of cytokine release syndrome and neurotoxicity of CAR T-cell therapy and associated prevention and management strategies.” Journal of Experimental & Clinical Cancer Research, 2021.
-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章
-
微信文章
-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章
-
微信文章